-
为纪念日军侵华战争中死难的中国同胞,中国政府设立12月13日为国家公祭日。在侵华史上,日军曾使用芥子气(化学式C4H8Cl2S)屠杀中国军民,下列对芥子气的说法正确的是
A. 有机物 B. 碱 C. 盐 D. 单质
难度: 简单查看答案及解析
-
维生素P的结构如图所示,其中R为烷烃基,维生素P是一种营养增补剂。下列关于维生素P的叙述正确的是( )
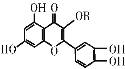
A. 分子中的官能团有羟基、碳碳双键、醚键、酯基
B. 若R为甲基,则该物质的分子式可以表示为C16H14O7
C. 该化合物遇三氯化铁溶液发生显色反应
D. 1 mol该化合物与氢气加成所需氢气的物质的量最多是7 mol
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g
B.反应3H2(g)+N2(g)
2NH3(g) △H=-92kJ·mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA
C.lmol·L-1的氯化铜溶液中,若Cl-的数目为2NA,则Cu2+的数目为NA
D.标准状况下,NO和O2各11. 2L混合充分反应,所得气体的分子总数为0.75 NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 胶体与溶液的本质区别在于是否可以发生丁达尔现象
B. 在常温下铁遇浓硫酸会钝化,所以可以用铁制容器来装运浓硫酸
C. 氯气具有漂白性,可以使湿润的有色布条褪色
D. 二氧化碳通入足量澄清石灰水中,没有白色沉淀生成
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是
A.氯气跟水反应:Cl2 + H2O= 2H++ Cl-+ ClO-
B.食醋与氨水反应:NH3·H2O+H+= NH4++H2O
C.NaHCO3 溶液中加少量Ca(OH)2溶液: 2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向Ba(OH)2溶液滴加NaHSO4溶液至Ba2+恰好沉淀:Ba2++2H++2OH-+SO42- = BaSO4↓+2H2O
难度: 中等查看答案及解析
-
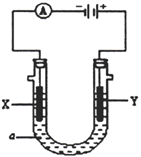
“电芬顿法”除去水体里有机污染物的原理如图所示,发生电芬顿反应:Fe2++H2O2== Fe3++OH-+·OH,生成的羟基自由基(·OH)能降解有机污染物。下列说法正确的是
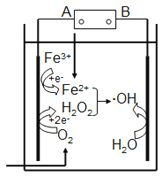
A. 电源的A极是正极,B极是负极
B. 阴极上O2、Fe3+、H2O2得电子发生还原反应
C. 阳极上发生电极反应:H2O-e-==•OH+H+
D. 常温常压下,消耗22.4LO2,可以产生4mol·OH
难度: 中等查看答案及解析
-
电解质溶液电导率越大导电能力越强。常温下,用0.100 mol·L-1盐酸滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似, Kb[(CH3)2NH·H2O]=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是
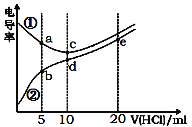
A.曲线①代表滴定二甲胺溶液的曲线
B.a点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH·H2O]
C.d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
D.b、c、e三点的溶液中,水的电离程度最大的是b点
难度: 中等查看答案及解析
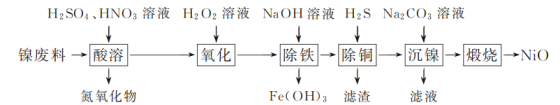
 ,
,