-
对于反应2SO2(g)+O2(g)2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积
C.移去部分SO2 D.降低体系温度
难度: 简单查看答案及解析
-
下列是4位同学在学习“化学反应速率与化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
难度: 简单查看答案及解析
-
对于可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡状态时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到化学平衡状态
C.达到化学平衡状态后,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率的关系为2v正(NH3)=3v正(H2O)
难度: 简单查看答案及解析
-
在一定温度下将1 mol CO和1 mol水蒸气放入一固定容积的密闭容器中,反应CO(g)+H2OCO2(g)+H2(g)达平衡后,得到0.6 mol CO2;再通入0.3 mol水蒸气,达到新平衡状态后,CO2的物质的量可能是( )
A.0.9 mol B.0.8 mol
C.0.7 mol D.0.6 mol
难度: 简单查看答案及解析
-
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b
C.a<b D.无法确定
难度: 简单查看答案及解析
-
如下图所示曲线a表示放热反应X(g)+Y(g)
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
难度: 简单查看答案及解析
-
可逆反应mA(g)
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
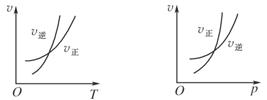
A.m>n,Q>0 B.m>n+p,Q>0
C.m>n,Q<0 D.m<n+p,Q<0
难度: 简单查看答案及解析
-
有一化学平衡:mA(g)+nB(g)
pC(g)+qD(g)(如图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )
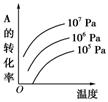
A.正反应吸热:m+n>p+q
B.正反应吸热:m+n<p+q
C.正反应放热:m+n>p+q
D.正反应放热:m+n<p+q
难度: 简单查看答案及解析
-
如图所示曲线表示其他条件一定时,反应:2NO+O2
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )

A.a点 B.b点 C.c点 D.d点
难度: 简单查看答案及解析
-
下列叙述中,不正确的是( )
A.某特定反应的平衡常数仅是温度的函数
B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D.化学平衡发生移动,平衡常数必发生变化
难度: 简单查看答案及解析
-
一定温度下,反应2SO2+O2
2SO3,达到平衡时,n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )
A.0.4 mol B.0.6 mol C.0.8 mol D.1.2 mol
难度: 简单查看答案及解析
-
在一个固定体积的密闭容器中,加入2 mol A和1 mol B发生反应:2A(g)+B(g)
3C(g)+D(g),达到平衡时C的浓度为W mol·L-1。若维持容器体积和温度不变,按下列四种方法改变起始物质及其量,达到平衡后C的浓度仍为W mol·L-1的是( )
A.4 mol A+2 mol B B.2 mol A+1 mol B+3 mol C+1 mol D
C.3 mol C+1 mol D+1 mol B D.3 mol C+1 mol D
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
难度: 简单查看答案及解析
-
(2011·潮州高二检测)水的三态的熵值的大小关系正确的是(Sm表示1 mol物质的熵值)( )
A.Sm(s)>Sm(l)>Sm(g) B.Sm(l)>Sm(s)>Sm(g)
C.Sm(g)>Sm(l)>Sm(s) D.Sm(s)=Sm(l)=Sm(g)
难度: 简单查看答案及解析
-
灰锡结构松散,不能用于制造器皿,而白锡结构坚固,可以制造器皿。现把白锡制成的器皿放在0 ℃、100 kPa的室内存放,它会不会变成灰锡而不能再继续使用(已知在0 ℃、100 kPa条件下白锡转化为灰锡反应的焓变和熵变分别为ΔH=-2 180.9 J·mol-1,ΔS=-6.6 J·mol-1·K-1当ΔH-TΔS<0时能自发反应)( )
A.会变 B.不会变
C.不能确定 D.升高温度才会变
难度: 简单查看答案及解析
-
(2009·天津理综)人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力。CO吸入肺中发生反应:CO+HbO2
O2+HbCO,37 ℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
A.CO与HbO2反应的平衡常数K=
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
难度: 简单查看答案及解析


