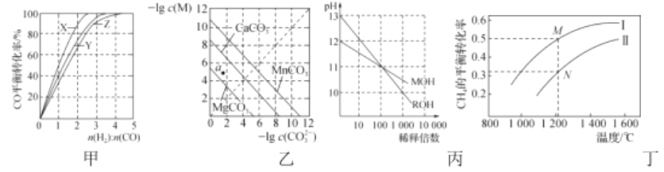
-
下列有关说法正确的是( )
A.室温下,0.1mol·L-1CH3COONa溶液加水稀释后,溶液中所有离子浓度均减少
B.若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化
C.铅蓄电池放电过程中,正极与负极的质量均增加
D.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Al3+、K+、Cl-、SO42-
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.久置氯水pH变小
B.温度升高,Kw增大
C.工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
D.高温比常温有利于NH3的合成
难度: 简单查看答案及解析
-
在容积为1L的密闭容器中,加入5molA物质,在一定条件下同时发生下列两个反应:(1)2A(g)
2B(g)+C(g);(2)A(g)
C(g)+D(g)。当达到平衡时,测得c(A)=2.5mol·L-1,c(C)=2.0mol·L-1。则下列说法中正确的是( )
A.达到平衡时c(B)为1.0mol·L-1
B.达到平衡时c(B)=2c(D)
C.达到平衡时c(D)为2.0mol·L-1
D.达到平衡时A的总转化率为40%
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.用氨水吸收足量的SO2气体:2OH-+SO2 =SO32-+H2O
B.Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2+ +OH-= CaCO3↓+H2O
C.NH4Al(SO4)2溶液与过量NaOH溶液反应:A13++4OH-= AlO2-+2H2O
D.NaClO将污水中的NH3氧化成N2:3ClO-+2NH3 =N2↑+3C1-+3H2O
难度: 简单查看答案及解析
-
氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是( )
A.一定温度下,反应2H2(g)+O2(g)=2H2O(g)能自发进行,该反应的ΔH>0
B.氢氧燃料电池的负极反应为:O2+2H2O+4e−=4OH−
C.常温常压下,氢氧燃料电池放电过程中消耗11.2LH2,转移电子的数目为6.02×1023
D.反应2H2(g)+O2(g)=2H2O(g)的ΔH可通过下式估算:ΔH=反应中断裂旧共价键的键能之和−反应中形成新共价键的键能之和
难度: 简单查看答案及解析
-
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
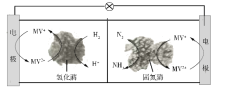
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
难度: 中等查看答案及解析
-
一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)
2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
2
4
6
8
n(SO3)/mol
0
0.8
1.4
1.8
1.8
下列说法正确的是( )
A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时
增大
难度: 中等查看答案及解析
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
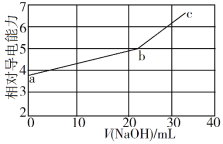
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
难度: 中等查看答案及解析
-
25℃时,向25mL0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )
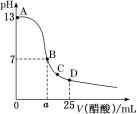
A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.用含a的代数式表示CH3COOH的电离常数K=
C.C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1
D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+)
难度: 困难查看答案及解析
-
现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是( )
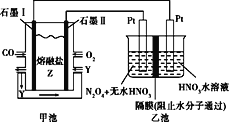
A.石墨Ⅰ是原电池的负极,发生氧化反应
B.乙池中,若使用质子交换膜,每生成1molN2O5,则有2mol H+通过交换膜进入右室
C.石墨II的电极反应式:O2+2CO2+4e-=2CO32-
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
难度: 中等查看答案及解析