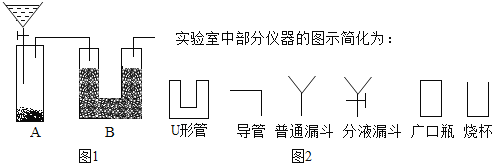
-
(1)请你参与下列探究:某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.这一现象激发起同学们的探究欲望,生成的是什么气体?
(提出猜想)从元素守恒的角度,放出的气体可能是SO2、O2、H2.
(查阅资料)SO2易溶于水,它能与NaOH反应生成Na2SO3.
(方案设计)依据上述猜想,实验小组同学分别设计了如下方案:
①甲同学认为是O2,则检验方法是______。
②乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与NaOH反应的化学方程式______。
③实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。如果放出的是O2和H2,你认为方案中的安全隐患是______,产生此隐患的原因:______(用方程式解释)。
老师说:“化学反应中,一种元素的化合价升高,肯定有元素的化合价降低,这是科学规律”.丙同学根据老师这句话分析判断:放出的气体肯定不是______。
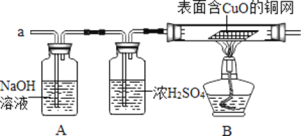
(实验探究)小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色,B装置的尾部有水珠生成;停止通气,再次称量装置A,发现质量无增减。结论:铁粉与硫酸铜溶液反应时,产生的气体是______。写出B装置中发生化学反应的方程式______。
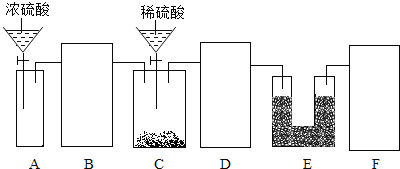
(2)某同学模仿物理课上学到的“串联电路”设计了如下气体制取与性质验证的组合实验.打开分液漏斗活塞后,A中出现大量气泡,B中白磷燃烧,C中液面下降,稀盐酸逐渐进入D中,请看图回答问题。
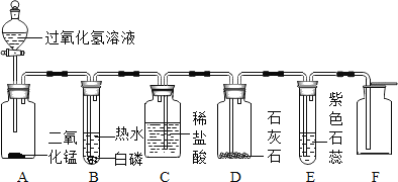
①A中发生反应的化学方程式为______。
②B中白磷能够燃烧的原因是______。
③E中的实验现象是______。
④用F装置收集气体的依据是______。
-
已知浓硫酸与焦炭在加热的条件下能发生反应,生成三种氧化物。某校研究性学习小组对此进行以下一系列的探究活动。
(提出猜想)浓硫酸与焦炭在加热条件下反应,生成H2O、SO2和CO2。
(查阅资料)经查阅资料得知:①CO2、SO2均可使澄清石灰水变浑浊;②SO2可使品红溶液的红色褪去,而CO2不能;③SO2可与酸性的KMnO4溶液反应使其褪色,而CO2不能;④无水CuSO4为白色粉末,遇水可生成蓝色胆矾。
(实验探究)用以下A—D四个装置组装成一套完整的实验装置,然后进行实验,验证猜想。

(1)本实验的发生装置应选用如下图所示三种装置中的___________装置(填序号)。

(2)为了验证三种产物,达到预期的实验目的,整套实验装置的正确组装顺序是(按导管口连接的先后顺序):发生装置导管口
 ________
________
(3)实验过程中,同学们观察到装置D中的无水CuSO4变为蓝色,由此得出产物中有_________的结论;同时还观察到以下实验现象:装置C中品红溶液( I)和酸性高锰酸钾溶液都褪色,品红溶液(Ⅱ)不褪色;装置B中澄清石灰水变浑浊。装置C中品红溶液( I)褪色,说明产物中有_________,酸性KMnO4溶液的作用是____,品红溶液(Ⅱ)不褪色,说明________;装置B中发生反应的化学方程式是___________________
(4)能确认反应产物中有CO2的实验现象是_____________。
(实验结论)本实验提出的猜想_________(填“成立”或“不成立”);
浓硫酸与木炭反应的化学方程式是____________________。
(交流讨论)实验结束后,同学们针对本实验进行讨论,其中张辉同学提出了“反应产物中可能还有一氧化碳”这样的一个观点。你是否支持张辉同学的观点?_______________(填“支持”或“不支持”),请你说出两点理由:①_____________;②____________________。
-
全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.
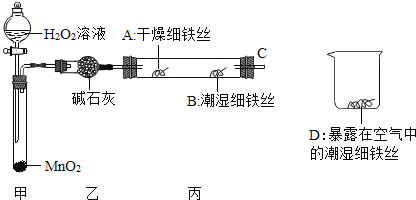
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接入到装有水的烧杯中,微热甲装置,说明气密性良好的现象是______。
(2)反应开始后,甲装置中反应现象是______,MnO2的作用______。
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与______和______有关。B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是______。
问题二:测定铁锈的组成
铁锈的成分主要为Fe2O3•H2O,还含有少量的FeCO3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N2氛围中,充分加热到质量不再减少.该过程中仅考虑发生: ,
, ,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3•H2O178,FeCO3116)
,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe2O3•H2O178,FeCO3116)
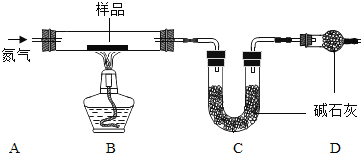
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO2和水蒸气的总质量为______g,D装置中碱石灰的作用是______。
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为______、______。
(3)经过改进后,测得m(H2O)=1.80g,m(CO2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe2O3•H2O的质量=______g。
②锈铁钉中FeCO3的质量=______g。
③锈铁钉中单质铁的质量分数=______。
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H2?______(填“有”或“无”),请通过计算说明_____。(假设铁在H2SO4和Fe2(SO4)3,混合溶液中先发生的反应为:Fe+Fe2(SO4)3=3FeSO4,Fe2(SO4)3的相对分子质量为400)