-
化学与生产、生活及环境密切相关,下列说法错误的是
A.江河入海口形成的三角洲与胶体聚沉有关
B.葡萄酒中通常含有微量SO2,既可以杀菌又可以防止营养成分被氧化
C.常用危险化学品标志中的数字主要表示的是危险的级别
D.酿酒工艺中加入的“酒曲”与面包工艺中加入的“发酵粉”作用不同
难度: 困难查看答案及解析
-
有机物分枝酸结构简式如图,分枝酸可用于生化研究。下列关于分枝酸的叙述正确的是
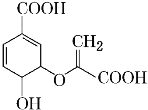
A.分子中含有3种官能团
B.1mol分枝酸最多可与3 mol NaOH发生中和反应
C.可与乙醇、乙酸反应,且反应类型不相同
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理不相同
难度: 中等查看答案及解析
-
下列实验操作、现象与结论均正确的是
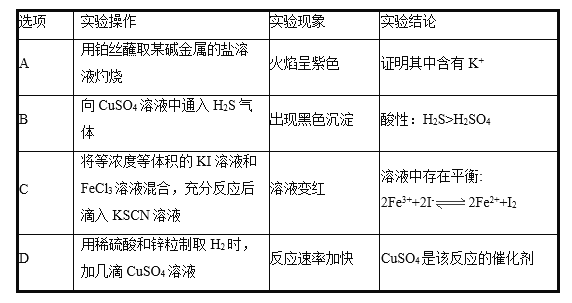
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA为阿伏加徳罗常数的值,下列说法正确的是
A.常温下,1L pH=13的Ba(OH)2溶液中OH-数目为0.2NA
B.在电解精炼粗铜的过程中,当阴极质量增重32 g时转移电子数目为NA
C.常温常压下,1 mol分子式为C2H6O的有机物中,含有C—O键的数目为NA
D.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为2NA
难度: 中等查看答案及解析
-
主族元素X、Y、Z、W的原子序数依次增加,且均不大于20,X的单质是手机电池重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W最外层电子数之和与Z的最外层电子数相等;W能形成多种氧化物。下列说法正确的是
A.常温下,Z的单质与Y的简单氢化物相遇,可能产生白烟
B.Z非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y;简单离子半径:Z<W
D.X、W的单质均为活泼金属,通常保存在煤油中
难度: 中等查看答案及解析
-
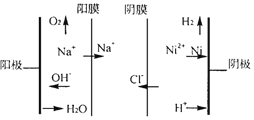
十九大报告中提出要“打赢蓝天保卫战”,意味着对污染防治比过去要求更高。某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如下,当该装置工作时,下列说法正确的是
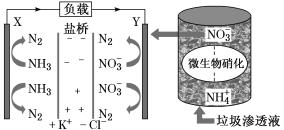
A.盐桥中Cl-向Y极移动
B.电路中流过7.5 mol电子时,共产生标准状况下N2的体积为16.8L
C.电流由X极沿导线流向Y极
D.Y极发生的反应为2NO3-+10e-+6H2O===N2↑+12OH—,周围pH增大
难度: 困难查看答案及解析
-
常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离出的OHˉ离子浓度(c)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是
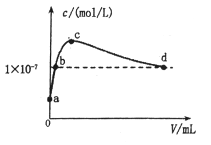
A.a点溶液中:水电离出的c(H+)=1×10-12 mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3ˉ)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3ˉ)
难度: 困难查看答案及解析
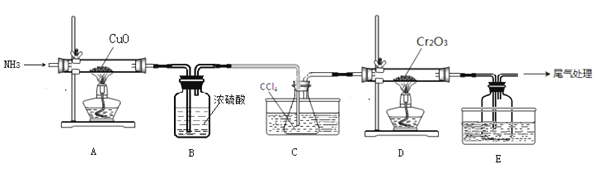
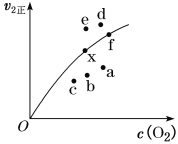
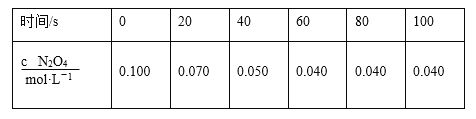

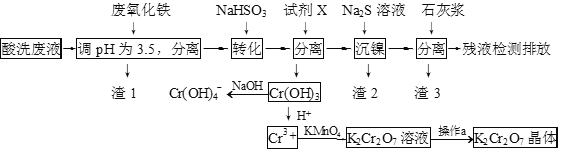
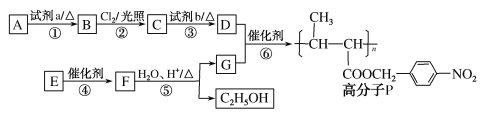
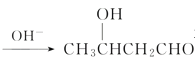 ,以乙醇为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________
,以乙醇为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________