-
下列关于物质应用的说法错误的是
A. 玻璃容器可长期盛放各种酸 B. 纯碱可用于清洗油污
C. 浓氨水可检验氯气管道漏气 D. Na2S可除去污水中的Cu2+
难度: 简单查看答案及解析
-
在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是( )
①氯化铝溶液中滴加氢氧化钠溶液 ②偏铝酸钠溶液中加盐酸
③氢氧化钠溶液中滴加氯化铝溶液 ④蛋白质溶液中滴入硫酸铜溶液
⑤氯化铝溶液中滴加氨水 ⑥硝酸银溶液中滴加氨水 ⑦氢氧化铁胶体滴加硫酸
A.①②④⑥ B.②③⑤⑦ C.①②⑥⑦ D.③④⑤⑥
难度: 中等查看答案及解析
-
已知反应:①Cl2+2KBr=2KCl+Br2 ②KClO3+6HCl=3Cl2+KCl+3H2O ③ 2KBrO3+Cl2=Br2+2KClO3,下面说法正确的
A.上述三个反应都有单质生成,所以都是置换反应
B.反应②中还原剂与氧化剂的物质的量之比为6:1
C.反应③中1mol Cl2反应,则氧化剂得电子的物质的量为10mol
D.氧化性由强到弱的顺序为:KClO3>KBrO3>Cl2>Br2
难度: 中等查看答案及解析
-
下列说法正确的是
A.阳离子只有氧化性,阴离子只有还原性
B.失电子难的原子获得电子的能力一定强
C.得到电子越多的氧化剂,其氧化性就越强
D.要实现Fe2+→Fe3+的转化,必须加入氧化剂
难度: 简单查看答案及解析
-
NaNO2是一种食品添加剂,既有致癌作用。酸性KMnO4溶液与NaNO2的反应为:
MnO4-+NO2-+H+=Mn2++NO3-+H2O(未配平)。下列叙述正确的是
A.反应中NO2-是氧化剂 B.反应过程中溶液pH减小
C.1mol KMnO4可以消耗2.5mol NaNO2 D.该反应可以说明氧化性NO3->MnO4-
难度: 中等查看答案及解析
-
下列解释事实的方程式不准确的是
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.碳酸钠溶液显碱性:CO32-+H2O
HCO3-+OH-
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列有关NaHSO3溶液的叙述正确的是
A.该溶液中,K+、Ca2+、Cl2、Br-可以大量共存
B.与FeCl3反应的离子方程式:SO32-+2Fe3++H2O=SO42-+2Fe2++2H+
C.和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O
D.能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为NA
B.1.7gH2O2中含有的电子数为0.9NA
C.1molNa2O2固体中含离子总数为4NA
D.标准状况下,2.24L戊烷所含分子数为0.1NA
难度: 中等查看答案及解析
-
寿山石{X4[Y4Z10](ZW)8}的组成元素均为短周期元素,X的最高价氧化物对应水化物常用于治疗胃酸过多,X的简单离子与ZW-含有相同的电子数,Y的单质是制造芯片的基础材料。下列说法正确的是()
A. 原子半径:Y>X >Z>W B. 最高价氧化物水化物的酸性:X >Y
C. NaW与水反应时作还原剂 D. 简单氢化物的热稳定性:Y>Z
难度: 中等查看答案及解析
-
下列对于过氧化钠的叙述中,正确的是( )
A.将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B.1 mol Na2O2与H2O完全反应,转移2 mol电子
C.充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D.a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
难度: 中等查看答案及解析
-
用下列装置进行的实验,不能达到相应实验目的的是

A. 装置甲:气体从a口进入,收集NH3 B. 装置乙:实验室测定中和热
C. 装置丙:实验室制取并收集乙酸乙酯 D. 装置丁:验证HCl气体易溶于水
难度: 困难查看答案及解析
-
下列实验操作所得的现象及结论均正确的是( )
选项
实验操作
现象及结论
A
将AlC13溶液加热蒸干
得到白色固体,成分为纯净的AlC13
B
将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液
有白色沉淀产生,则Na2SO3己变质
C
向FeI2溶液中通入少量C12
溶液变黄,则C12的氧化性强于Fe3+
D
用量筒量取一定体积的浓硫酸时,仰视读数
所量取的浓硫酸体积偏大
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2015年冬季,雾霾天气严重影响了我国北方地区。国内电力行业和供暖部门引进先进脱硫工艺以减少污染。目前脱硫工艺涉及的主要反应有:①H2S(g)+
O2(g)===SO2(g)+H2O(g) ΔH1
②S(g)+O2(g)===SO2(g) ΔH2
③S(g)+H2(g)===H2S(g) ΔH3则“2H2(g)+O2(g)===2H2O(g) ΔH4”中ΔH4的正确表达式为( )
A. ΔH4=
(ΔH1+ΔH2-ΔH3) B. ΔH4=2(ΔH1-ΔH2+ΔH3)
C. ΔH4=(ΔH1-ΔH2+ΔH3) D. ΔH4=
ΔH1-2(ΔH2-ΔH3)
难度: 简单查看答案及解析
-
将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.
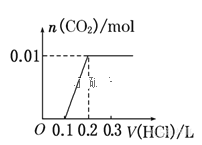 B.
B.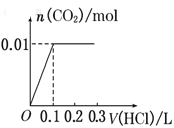
C.
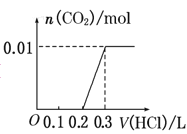 D.
D.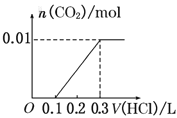
难度: 困难查看答案及解析
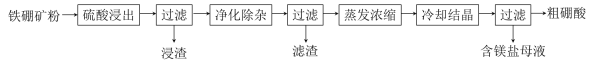
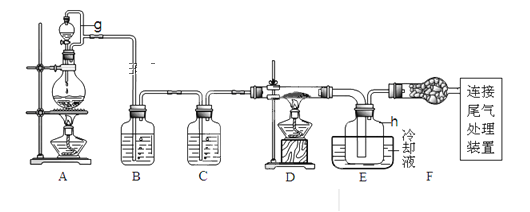
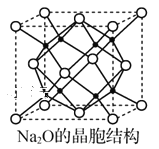

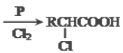
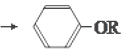 +NaCl
+NaCl