-
将少量SO2 气体通入BaC12和FeC13的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
A. 该实验表明SO2有漂白性 B. 白色沉淀为BaSO3
C. 该实验表明FeC13有还原性 D. 反应后溶液酸性增强
难度: 中等查看答案及解析
-
“水飞”是传统中医中将药材与适量水共研细,取极细药材粉末的方法。《医学人门》中记载提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干。”文中涉及的操作方法是
A. 洗涤、溶解、过滤、灼烧 B. 洗涤、溶解、倾倒、蒸发
C. 洗涤、萃取、倾倒、蒸馏 D. 洗涤、萃取、过滤、蒸发
难度: 简单查看答案及解析
-
下列说法正确的是:
A. 由苯制备硝基苯的反应属于加成反应
B. 甲烷和氯气的物质的量之比为1∶1混合反应时,只生成一氯甲烷和HCl
C. 测定中和热实验中,用量筒分别量取50mL0.55 mol•L-1NaOH溶液和50mL0.50mol•L-1的盐酸溶液测温备用,当碱溶液加入酸中时,要一次性迅速倒入
D. 用AlCl3溶液做导电实验,验证AlCl3是离子化合物还是共价化合物
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是
A. 常温下,60gSiO2分子中含有Si-O极性共价键的数目为4NA
B. 常温下,16.8g铁粉与足量的浓硝酸反应转移电子数为0.9NA
C. 叠氮化铵(NH4N3)发生爆炸反应:NH4N3=2N2↑+2H2↑,则每收集标况下89.6L气体,爆炸时转移电子数为4NA
D. 0.1mo/L的Na2CO3溶液中H2CO3、HCO3-、CO32-的粒子总数为0.1NA
难度: 中等查看答案及解析
-
下列各组离子中因发生氧化还原反应而不能大量共存的是( )
A. 无色透明溶液中:Fe3+、NH4+、SO42-、Cl-
B. Ba(AlO2)2溶液中:K+、Mg2+、HCO3-、NO3-
C. 能使酚酞变红色的溶液中:Na+、Ba2+、Cl-、Br-
D. pH=0的溶液中:Na+、K+、S2-、SO32-
难度: 困难查看答案及解析
-
为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是( )
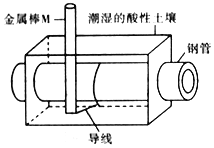
A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M将电子通过导线流向钢管
C. 在潮湿的酸性士壤中H+向金属棒M移动,抑制H+与铁的反应
D. 该方法称为牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物是常见的燃料,Z的简单离子的半径是所有短周期主族元素阳离子中最大的。由H、X 和Y 三种元素形成的一种盐中X 有两种不同的价态,且该化合物撞击时会发生爆炸。下列说法错误的是
A. X 的简单氢化物的热稳定性比W的强
B. Z 与其他三种元素既不同主族也不同周期
C. W .Y 和Z三种元素只能形成一种离子化合物
D. Y的简单离子的半径比X的简单离子的半径小
难度: 中等查看答案及解析
-
下列有关资源的开发利用的说法中正确的是
A. 从海水中提取溴单质的过程一定涉及氧化还原反应
B. 从海水中可以得到MgCl2,电解MgCl2溶液可制备Mg和Cl2
C. 天然气、乙醇和水煤气分别属于化石能源、不可再生能源和二次能源
D. Cu、Al、Hg可以分别用热还原CuO、Al2O3、HgO的方法得到
难度: 中等查看答案及解析
-
甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法不正确的是( )
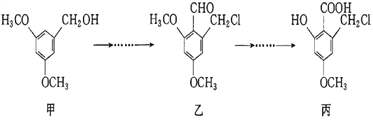
A. 乙、丙都能发生银镜反应
B. 可用FeCl3溶液鉴别甲、丙两种有机化合物
C. 甲分子中所有碳原子可能共平面
D. 乙、丙两种有机化合物均可与NaOH溶液发生反应
难度: 中等查看答案及解析
-
硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4。下列说法错误的是( )
A. 氧化产物、还原产物的物质的量之比为1∶1
B. 若0.5molNa2S2O3作还原剂;则转移4mol电子
C. 当Na2S2O3过量时,溶液能出现浑浊
D. 硫代硫酸钠溶液吸收氯气后,溶液的pH降低
难度: 困难查看答案及解析
-
已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。

③
化学键
Si-O
O=O
Si-Si
断开1mol共价键所需能量/KJ
460
500
176
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
难度: 中等查看答案及解析
-
常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
难度: 困难查看答案及解析
-
下列有关实验操作、实验现象和所得结论均正确的是
实验操作
实验观象
结论
A
往淀粉水解后的溶液中加入足量新制氢氧化铜并加热
有砖红色沉淀生成
淀粉完全水解
B
用0.100mol·L-1盐酸滴定未知浓度NaOH 溶液(甲基橙做指示剂)
溶液由橙色变红色,且在半分钟内不恢复
滴定到达终点
C
将BaCl2溶液滴入某溶液
生成白色沉淀
该溶液一定存在SO42-
D
往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液
红色煺去
证明CO32-水解呈碱性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知某酸H2B 在水溶液中存在下列关系:H2B=H++HB-,HB-
H++B2- 。则下列关于酸式盐NaHB 溶液的说法中正确的是
A. 电离方程式:NaHB=Na++H++B2-
B. NaHB 溶液可能呈酸性或碱性
C. NaHB 和NaOH 溶液反应的离子方程式:HB-+OH-= H2O+B2-
D. 该溶液中:c(Na+)=c(H2B)+c(HB-)+c(B2-)
难度: 中等查看答案及解析
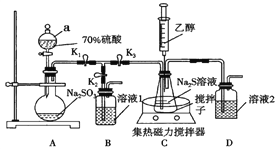

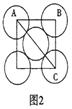
 为原料可制备香料E(C11H12O2),其合成路线如下:
为原料可制备香料E(C11H12O2),其合成路线如下:
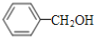 的同分异构体有______种(不包含
的同分异构体有______种(不包含