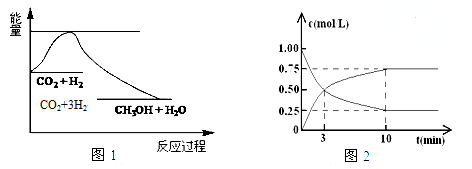
-
下列措施不符合节能减排的是 ( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
难度: 简单查看答案及解析
-
反应 CO + H2O(g)
CO2 + H2 在800℃达到平衡时,分别改变下列条件,K值发生变化的是( )
A.将压强减小至原来的一半 B.将反应温度升高至1000℃
C.添加催化剂 D.增大水蒸气的浓度
难度: 中等查看答案及解析
-
仅改变下列一个条件,通过提高活化分子的百分数来提高反应速率的是( )
A.加热 B.加压 C.加负催化剂 D.加大反应物浓度
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.放热反应在任何温度下均能自发进行
B.自发过程指的是常温下,不借助外力就能自动进行的过程
C.熵增加的放热反应在任何温度下均能自发进行
D.对于同一物质,其混乱度大小为S(g)<S(l)<S(s)
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)═2CO2(g)△H=﹣566kJ•mol﹣1
N2(g)+O2(g)═2NO(g)△H=+180kJ•mol﹣1
则2CO(g)+2NO(g)═N2(g)+2CO2(g)的△H是( )
A.﹣386 kJ•mol﹣1 B.+386 kJ•mol﹣1 C.﹣746 kJ•mol﹣1 D. +746 kJ•mol﹣1
难度: 中等查看答案及解析
-
对于:2C4H10(g)+13O2(g)═ 8CO2(g)+10H2O(l);△H=﹣5800kJ/mol的叙述中不正确的是( )
A.该反应的反应热为△H=﹣5800kJ/mol,是放热反应
B.该反应的△H与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25℃、101kPa下,2molC4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ
D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol
难度: 中等查看答案及解析
-
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
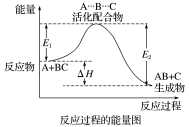
A.反应过程可表示为
B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
难度: 中等查看答案及解析
-
关于如图所示的原电池,下列说法正确的是( )
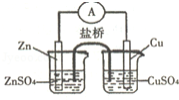
A.电子从锌电极通过电流表流向铜电极
B.盐桥中的阴离子向硫酸铜溶液中迁移
C.取出盐桥后,电流计的指针仍发生偏转
D.铜电极上发生的电极反应是2H++2e﹣═H2↑
难度: 简单查看答案及解析
-
用惰性电极电解CuSO4和NaCl的混合溶液,开始时阴极和阳极上析出的物质分别是( )
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
难度: 简单查看答案及解析
-
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如右。该电池工作时,下列说法正确的是( )

A.Mg电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH增大
D.溶液中Cl-向正极移动
难度: 简单查看答案及解析
-
在2A+B
3C+5D反应中,表示该反应速率最快的是( )
A、v (A)= 0.5 mol/(L·s) B、v (B)= 0.3 mol/(L·s)
C、v (C)= 0.8 mol/(L·s) D、v (D)= 1 mol/(L·s)
难度: 简单查看答案及解析
-
如图所示的钢铁的析氢腐蚀与吸氧腐蚀中,下列说法正确的是( )

A.碳表面发生氧化反应
B.钢铁被腐蚀的最终产物为FeO
C.生活中钢铁制品的腐蚀以图①所示为主
D.图②中,正极反应式为O2+4e-+2H2O===4OH-
难度: 简单查看答案及解析
-
下列图示中关于铜电极的连接错误的是( )

难度: 简单查看答案及解析
-
在密闭容器中充入4molHI,在一定温度下2HI(g)
H2(g) +I2(g)达到平衡时,有30%的HI发生分解,则平衡时混合气体总的物质的量是( )
A.4mol B.3.4mol C.2.8mol D.1.2mol
难度: 中等查看答案及解析
-
在恒温下的密闭容器中,有可逆反应N2+3H2
2NH3(该反应放热),不能说明已达到平衡状态的是( )
A.1molN≡N键断裂的同时,有6molN—H键断裂
B.反应器中压强不随时间变化而变化
C.v正(NH3)= v逆(H2)
D.混合气体平均相对分子质量保持不变
难度: 简单查看答案及解析
-
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4====Li2Mn2O4。下列说法正确的是( )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-====Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-====Li
难度: 中等查看答案及解析
-
如下图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )

A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B.K1闭合,石墨棒周围溶液pH逐渐升高
C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D.K2闭合,电路中通过0. 2NA个电子时,两极共产生0. 1 mol气体
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)
4NO2(g)+O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是( )
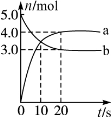
A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
难度: 中等查看答案及解析
-
增大压强,对已达平衡的反应3A(g)+B(g)====2C(g)+2D(s)产生的影响是( )
A.正反应速率加大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率加大,平衡向逆反应方向移动
C.正、逆反应速率都加大,平衡不发生移动
D.正、逆反应速率都加大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以使平衡发生移动
难度: 中等查看答案及解析