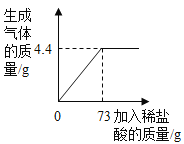
-
某不纯的铁5.6克与足量的稀硫酸反应生成0.23克氢气,则铁中混有的物质可能是
A. 锌 B. 碳 C. 铝 D. 银
难度: 困难查看答案及解析
-
实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( )
①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A. ①② B. ①③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
向AgNO3和Mg(NO3)2溶液中加入一定量Zn粉和Cu粉,充分反应后过滤,得到滤渣和蓝色滤液。关于该滤渣和滤液说法正确的是
A. 向滤渣中加入稀盐酸,可能有气泡产生 B. 滤液中一定有Cu(NO3)2、Mg(NO3)2、Zn(NO3)2
C. 滤渣中一定有Ag,可能有Cu和Zn D. 滤液中一定无AgNO3,可能有Zn(NO3)2
难度: 困难查看答案及解析
-
下列实验现象的描述中,错误的是( )
A.铜丝插入硫酸铝溶液中,铜丝表面有银白色固体析出
B.打开盛有浓盐酸试剂瓶的瓶塞,在瓶口上方出现大量白雾
C.硫在氧气中燃烧产生蓝紫色火焰、放热、生成有刺激性气味的气体
D.氧化钙放入水中,液体温度升高
难度: 中等查看答案及解析
-
下列事实能说明铝的金属活动性比铁或铜强的是
A.铝在地壳中含量比铁高 B.铝的熔点低于铜的熔点
C.空气中铁比铝更容易被腐蚀 D.铝丝在硫酸铜溶液中能形成“铜树”
难度: 简单查看答案及解析
-
在20 ℃时,向某氯化钠溶液中加入一定量的氯化钠固体,充分搅拌后,所得溶液的有关叙述正确的是( )
A.溶质质量一定增加 B.溶液质量一定增加
C.溶液浓度一定变大 D.溶剂质量一定不变
难度: 中等查看答案及解析
-
要下列方法中,一定能使固体的不饱和溶液变为饱和溶液的是 ( )
A.增大压强 B.升高温度 C.降低温度 D.增加溶质
难度: 简单查看答案及解析
-
要使右图装置中的小气球鼓起来,则使用的固体和液体可以是
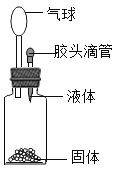
①硝酸铵和水; ②铁和稀硫酸; ③固体氢氧化钠和水;
④生石灰和水; ⑤石灰石和稀盐酸
A. ①②③④⑤ B. ②③④⑤
C. ②③⑤ D. ②④⑤
难度: 简单查看答案及解析
-
下列有关溶解度的说法正确的是 ( )
A.100 g水中最多溶解某物质40 g,则该物质的溶解度为40 g
B.20 ℃时,可把20 g氯化钠溶解在100 g水中,所以20 ℃时,氯化钠的溶解度为20 g
C.硝酸钾在20 ℃时的溶解度为31.6 g,则100 g硝酸钾溶液中含有硝酸钾31.6 g
D.物质溶解的过程中,搅拌不能增大物质的溶解度
难度: 简单查看答案及解析
-
保持温度不变,向一接近饱和的硝酸钾溶液中加入硝酸钾晶体,下列图象所反映的关系正确的是( )
A.
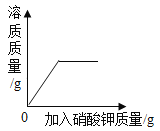 B.
B.C.
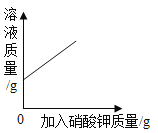 D.
D.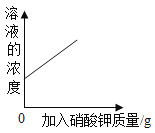
难度: 中等查看答案及解析
-
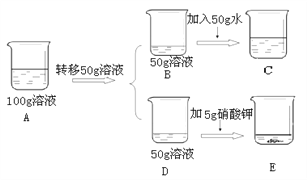
25 ℃时,向下列4只盛有100 g水的烧杯中,分别加入不同质量的KCl固体,充分溶解。下列判断不正确的是( )
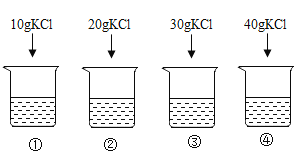
A.溶质质量分数①<②<③<④ B.只有④是25 ℃时的饱和溶液
C.②的溶质质量分数是①的2倍 D.升温可将①②③④中的饱和溶液转变为不饱和溶液
难度: 中等查看答案及解析
-
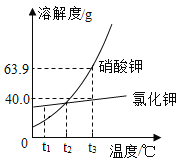
a、b两种固体物质的溶解度曲线如图所示,下列说法中不正确的是( )
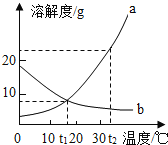
A.t1℃时,a、b物质的溶解度相等
B.a物质的溶解度随温度的升高而增大,b物质的溶解度随温度的升高而减小
C.t2℃时,将a、b两物质的饱和溶液分别降温至t1℃,所得的溶液溶质质量分数相等
D.提纯a中混有少量的b,可采用降温结晶的方法
难度: 中等查看答案及解析
-
下图是氢氧化钙的溶解度曲线。在冬天气温为5℃时配制的氢氧化钙饱和溶液,在夏天气温为38℃时(水的蒸发忽略不计),不可能出现的情况是()
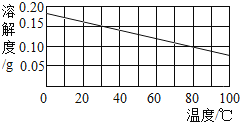
A. 溶液变浑浊
B. 溶液变为不饱和
C. 溶液质量变小
D. 溶质质量分数变小
难度: 中等查看答案及解析
-
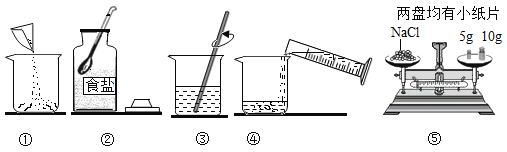
如图所示是利用海水提取粗盐的过程:
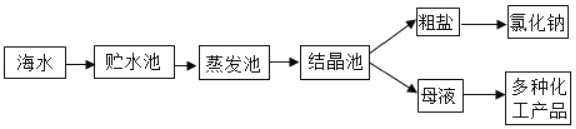
根据海水晒盐的原理,下列说法中正确的是( )
A. 海水是纯净物
B. 在蒸发池中,海水中氯化钠的质量逐渐增加
C. 在蒸发池中,海水中水的质量逐渐增加
D. 析出晶体后的母液是氯化钠的饱和溶液
难度: 简单查看答案及解析
-
下列关于金属性质说法正确的是( )
A.“真金不怕火炼”说明黄金的熔点很高
B.高炉炼铁的废气不能直接排放到空气中
C.沙漠地区金属不易锈蚀的原因是沙漠地区氧气浓度低
D.从化学的角度分析,古代钱币不用铁铸造的主要原因是铁的冶炼困难
难度: 简单查看答案及解析
-
取一定量打磨后的铝片于某容器中,再逐渐加入稀盐酸。加入稀盐酸的质量与有关量的变化关系图错误的是
A.
B.
C.
D.
难度: 困难查看答案及解析
-
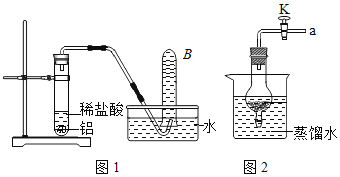
如图,将足量的等质量的锌和铁分别放入左、右试管中,加入等质量、稀盐酸等质量分数的稀盐酸,充分反应后,冷却到室温,(U型管内为水,初始液面相平,反应过程中装置气密性良好)下列说法正确的是( )
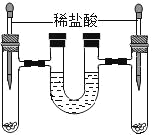
A.U型管中液面一定相平
B.U型管中液面可能左升右降
C.两试管中所得溶液的质量相等
D.右试管中溶液由无色变成黄色
难度: 简单查看答案及解析
-
等质量的三种金属分别与足量的、浓度相同的盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列有关说法正确的是(金属不是K、Na、Ca,且与盐酸反应形成化合物中化合价均为+2价)( )
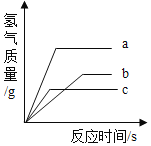
A.三种金属的活动性顺序是a>b>c
B.三种金属产生H2的质量a>c>b
C.三种金属最终消耗盐酸的质量相等
D.三种金属的相对原子质量大小关系是c>b>a
难度: 困难查看答案及解析
-
分别向50gFeSO4和CuSO4溶液中,加入一定质量Mg粉恰好完全反应。随Mg粉消耗,Mg粉与溶液中FeSO4、CuSO4的质量变化见图。请读取图象信息并结合金属活动性服序分析,下面说法不合理的是
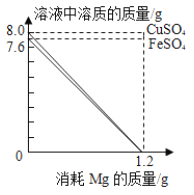
A.反应前,溶液中溶质质量分数:FeSO4<CuSO4
B.反应后,两溶液底部分别析出的金属是Fe和Cu
C.反应后,两溶液底部析出金属的质量:Fe<Cu
D.反应后,若FeSO4和CuSO4对应新溶液的溶质质量分数分别为A、B,则A>B
难度: 中等查看答案及解析