-
醋酸是电解质,下列能说明醋酸是弱电解质的组合是
①醋酸与水能以任意比例互溶
②白醋中滴入石蕊试液呈红色
③0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大
④蛋壳浸入白醋中有气体放出
⑤0.1mol/L醋酸钠溶液pH=8.9
⑥大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2的速率慢
A. ②⑤⑥ B. ③④⑤⑥ C. ③⑤⑥ D. ①②
难度: 中等查看答案及解析
-
下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂
C.着色剂 D.增稠剂
难度: 中等查看答案及解析
-
在一支25mL的滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,所需NaOH溶液的体积为( )
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
难度: 简单查看答案及解析
-
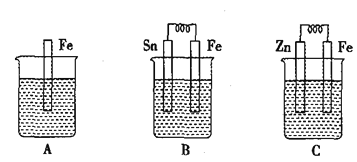
下列各装置中,能构成原电池的是( )
A.

B.
C.

D.
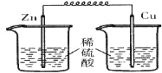
难度: 简单查看答案及解析
-
下列属于非电解质的是
A.氢气 B.蔗糖溶液 C.已烷 D.硫化钠
难度: 简单查看答案及解析
-
已知反应A(g)+3B(g)==2C(g)+2D(g)在四种不同的情况下的反应速率分别表示如下,则反应速率最快的是
A.v(A)=0.15mol/(L·S) B.v(B)= 0.6 mol/(L·S)
C.v(C)= 0.4mol/(L·S) D.v(D)= 0.45mol/(L·S)
难度: 简单查看答案及解析
-
下列叙述中,正确的是( )
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④⑤ C.③④ D.④
难度: 中等查看答案及解析
-
下列过程中,需要通电后才能进行的是
①电离 ②电解 ③电镀 ④电泳 ⑤电化腐蚀
A.①②③ B.②③④ C.②④⑤ D.全部
难度: 简单查看答案及解析
-
下列各组物质中,都是强电解质的是( )
A.HBr、HCl、BaSO4
B.NH4Cl、CH3COOH、Na2S
C.NaOH、Ca(OH)2、NH3·H2O
D.HClO、NaF、Ba(OH)2
难度: 中等查看答案及解析
-
下列方程式中,能够正确表示水解反应的是
A.HCO3-+ H2O
CO32-+ H3O+ B.S2-+ 2H2O
H2S+ 2OH-
C.CO2+H2O
HCO3-+H+ D.CO32-+ H2O
HCO3-+OH-
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e-=Fe3+
难度: 简单查看答案及解析
-
在25 ℃,在某无色溶液中由水电离出的C(OH-)= 1×10-13mol/L,一定能大量共存的离子组是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列溶液一定呈碱性的是
A.pH=8的溶液 B.含有OH-离子的溶液
C.NaCl溶液 D.c(OH-)>c(H+)的溶液
难度: 中等查看答案及解析
-
下列物质在水溶液中的电离方程式正确的是( )
A.H2S
2H++S2-
B.NaHCO3
Na++H++CO32—
C.NaHSO4===Na++H++SO42—
D.HF===H++F-
难度: 简单查看答案及解析
-
关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
难度: 中等查看答案及解析
-
下列说法正确的是
A.向0.1 mol/L Na2CO3溶液中滴加酚酞,溶液变红 B.Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中 C.乙醇和乙酸都能溶于水,都是电解质 D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
难度: 中等查看答案及解析
-
能使水的电离平衡右移,且其水溶液显碱性的离子是
A.H+ B.OH- C.Al3+ D.HCO3-
难度: 简单查看答案及解析
-
室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中
不变
难度: 简单查看答案及解析
-
关于镀铜和电解精炼铜,下列说法中正确的是( )
A.都用粗铜作阳极、纯铜作阴极
B.电解液的成分都保持不变
C.阳极反应都只有Cu-2e-=Cu2+
D.阴极反应都只有Cu2++2e-=Cu
难度: 简单查看答案及解析
-
在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl
AgI
Ag2S
Ksp
1.8×10-10
8.51×10-16
6.3×10-50
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
难度: 简单查看答案及解析
-
有酚酞的0.1 mol/L氨水中加入少量的 NH4Cl晶体,则溶液颜色 ( )
A.变深 B.变浅 C.变蓝 D.不变
难度: 简单查看答案及解析
-
下列水溶液一定呈中性的是
A.c(NH4+)=c(C1-)的NH4Cl 溶液
B.c(H+)=1×10-7mol·L-1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH= 11的碱等体积混合后的溶液
难度: 中等查看答案及解析
-
对外加电流的保护中,下列叙述正确的是
A.被保护的金属与电源的正极相连
B.被保护的金属与电源的负极相连
C.在被保护的金属表面上发生氧化反应
D.被保护的金属表面上不发生氧化反应,也不发生还原反应
难度: 中等查看答案及解析
-
用惰性电极分别电解下列物质的水溶液一段时间后,氢离子浓度不会改变的是( )
A.NaCl B.Na2SO4 C.AgNO3 D.CuSO4
难度: 简单查看答案及解析
-
将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性 B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
难度: 简单查看答案及解析