-
下列判断错误的是 ( )
①反应NH3(g)+HCl(g) ══ NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
②CaCO3(s) ══ CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
③一定温度下,反应MgCl2(l) ══ Mg(l)+Cl2(g)的ΔH>0、ΔS>0
④常温下,反应C(s)+CO2(g) ══ 2CO(g)不能自发进行,则该反应的ΔH>0
A.①③ B.②③ C.②④ D.①②
难度: 中等查看答案及解析
-
下列产品、设备在工作时由化学能转变成电能的是( )




A.长征5号火箭使用的液氧发动机
B.北斗导航卫星的太阳能板电池
C.位于江苏的海上风力发电机
D.世界上首部可折叠柔屏手机
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在食品中使用下列试剂的目的与化学反应速率无关的是()
A.着色剂 B.催熟剂 C.抗氧化剂 D.防腐剂
难度: 简单查看答案及解析
-
一定条件下反应:
则
中R的化合价是()
A.
B.
C.
D.
难度: 中等查看答案及解析
-
把一定量的X气体和Y气体混合于容积为2L的容器中,使其发生如下反应:
,5min达到平衡状态,消耗Y为
,这段时间用W表示的平均速率为
,则n的值()
A.1 B.2 C.3 D.4
难度: 简单查看答案及解析
-
少量铁粉与
的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变
的产量,可以使用如下方法中的( )
①加
②加
固体 ③滴入几滴浓盐酸
④改用
的硝酸 ⑤加
溶液 ⑥滴加几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发) ⑧改用
的盐酸
A. ③⑤⑥⑦ B. ③⑦⑧ C. ③⑥⑦⑧ D. ③④⑥⑦⑧
难度: 中等查看答案及解析
-
反应
过程中的能量变化如图所示:下列说法正确的是()
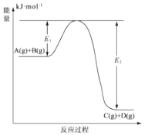
A.上述反应为吸热反应
B.上述反应放出的热量为
C.
的能量一定大于
D.反应物的总能量比生成物的总能量高
难度: 简单查看答案及解析
-
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是()
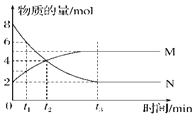
A.反应的化学方程式为:
B.
时,正逆反应速率相等
C.
时,当反应达最大限度时,化学反应随即停止
D.
时,反应达到平衡时,压强是开始时的
倍
难度: 中等查看答案及解析
-
已知:①N2(g)+3H2(g)=2NH3(g)
;②2H2(g)+O2(g)=2H2O(g)
.则反应
:
的
为
A.
B.
C.
D.
难度: 简单查看答案及解析
-
利用反应NO2+NH3→N2+H2O(未配平)消除NO2的简易装置如图所示。下列说法不正确的是( )
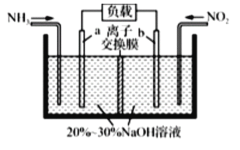
A.a电极反应式是
B.消耗标准状况下
时,被消除的NO2的物质的量为
C.若离子交换膜是阳离子交换摸,装置右室中溶液的碱性增强
D.整个装置中NaOH的物质的量不断减少
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A.Z为0.3 mol·L-1 B.Y2为0.4 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
难度: 简单查看答案及解析
-
下列说法正确的是()
A.
 图中,随着电解的进行,溶液中
图中,随着电解的进行,溶液中增大
B.
 图中,Mg电极作电池负极
图中,Mg电极作电池负极C.
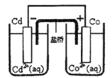 图中,发生的反应为
图中,发生的反应为D.
 图中,K分别与M、N连接,Fe电极均受到保护
图中,K分别与M、N连接,Fe电极均受到保护难度: 中等查看答案及解析
-
已知反应 2NH3
N2 + 3H2,在某温度下的平衡常数为0.25,在此条件下,氨的合成反应
N2 +
H2
NH3的平衡常数为
A.4 B.2 C.1 D.0.5
难度: 简单查看答案及解析
-
在一个固定容积的密闭容器中发生可逆反应:
,不能说明达到平衡状态的标志是()
A.体系的压强不再改变
B.混合气体密度不再改变
C.反应速率
正
逆
D.混合气体平均相对分子质量不再改变
难度: 简单查看答案及解析
-
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入
和
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液
滴有几滴酚酞
电解实验如图所示。下列说法不正确的是
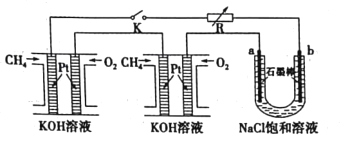
A.甲烷燃料电池正极反应:
B.电解过程中a极附近会出现红色
C.将a、b两极的产物相互反应可得到“84”消毒液的有效成分
D.标况下每个电池甲烷通入量为1L,反应完全,理论上最多能产生氯气8L
难度: 中等查看答案及解析
-
在下列各组溶液中,离子一定能大量共存的是 ()
A.某无色透明酸性溶液中:
、
、
、
B.某强酸性的溶液中:
、
、
、
C.某强碱性溶液中:
、
、
、
D.某无色碱性溶液中:
、
、
、
难度: 简单查看答案及解析
-
电解池中,阳极的电极材料一定()
A.发生氧化反应 B.与电源正极相连
C.是铂电极 D.得电子
难度: 简单查看答案及解析
-
2008年12月15日,全球第一款不依赖专业充电站的双模电动车--比亚迪F3DM双模电动车在深圳正式上市.比亚迪F3DM双模电动车代表着“科技
绿色明天”,运用了众多高新科技,开启了电动车的新时代,同时也实现了中国力量领跑世界.镍镉
可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
 有关该电池的说法正确的()
有关该电池的说法正确的()A.充电过程是化学能转化为电能的过程
B.充电时阳极反应:
C.放电时负极附近溶液的酸性增强
D.放电时电解质溶液中的
向正极移动
难度: 中等查看答案及解析
-
将
和
充入
的恒容密闭容器中,发生反应
,
后达到平衡状态,X的浓度为
。下列叙述正确的是
A.平衡时,
B.
后,反应停止
C.
时,升高温度,反应速率减小
D.用X表示的反应速率为
难度: 简单查看答案及解析
-
利用下图装置进行实验,开始时,a、b两处液面相平,密封放置一段时间后,下列有关说法正确的是 ()
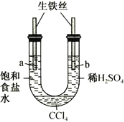
A.a管发生析氢腐蚀,b管发生吸氧腐蚀
B.一段时间后,b管液面高于a管液面
C.a处溶液的pH增大,b处溶液的pH减小
D.a、b两处具有相同的电极反应式:
难度: 中等查看答案及解析
-
某太阳能电池的工作原理如图所示。下列说法正确的是( )
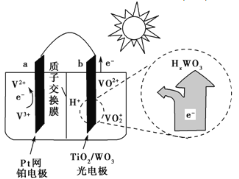
A. 光照时,b极的电极反应式为VO2+-e-+H2O=VO2++2H+
B. 光照时,每转移2 mol电子,有2 mol H+由a极区经质子交换膜向b极区迁移
C. 夜间,a极的电极反应式为V3++e-=V2+
D. 硅太阳能电池供电原理与该电池相同
难度: 中等查看答案及解析
-
下列实验操作能达到目的是()
A.加热氯化铵固体制取氨气
B.检验乙醇中是否含水:用无水硫酸铜,观察是否变蓝色
C.除去乙醛中的乙酸杂质:加入氢氧化钠溶液洗涤,分液
D.滴有酚酞的碳酸钠中,加入氯化钡溶液后,红色变浅,证明碳酸钠溶液中存在水解平衡
难度: 中等查看答案及解析