-
化学与生产、生活、科技密切相关。下列叙述错误的是
A.汽车尾气中的氮氧化物主要是汽油燃烧的产物
B.硅胶常用作食品干燥剂,也可以用作催化剂载体
C.距今三千年前的金沙遗址“太阳神鸟”仍璀璨夺目,是因为金的化学性质稳定
D.“玉兔二号”月球车首次实现在月球背面着陆,其太阳能电池帆板的材料是硅
难度: 简单查看答案及解析
-
双酚A是重要的有机化工原料,从矿泉水瓶、医疗器械到食品包装袋都有它的身影,其结构如图所示。下列关于双酚A的说法正确的是
A.分子式为C15H10O2
B.一定条件下能发生取代反应、氧化反应
C.与
互为同系物
D.苯环上的二氯代物有4种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列说法正确的是
A.12g
的原子核内中子数为6NA
B.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
C.25℃时,1L pH=2的H2C2O4溶液中含H+的数目为0.02NA
D.标准状况下,2.24L CO2与足量Na2O2反应转移的电子数为0.1NA
难度: 中等查看答案及解析
-
右下表是元素周期表的一部分。W、X、Y、Z为短周期元素,其中X的单质既能溶于强酸又能溶于强碱溶液。下列叙述正确的是
W
X
Y
Z
A.简单离子半径:Z>X>W
B.气态氢化物的热稳定性:Y>Z
C.四种元素中,X的氧化物熔点最高
D.W的氧化物对应的水化物均为强酸
难度: 中等查看答案及解析
-
下列实验操作与现象不相匹配的是
实验操作
实验现象
A
向盛有Ba(NO3)2溶液的试管中通入CO2
产生白色沉淀
B
向盛有KI溶液的试管中滴加氯水和CCl4液体,振荡
下层溶液变为紫红色
C
向盛有Na2S2O3溶液的试管中先滴入酚酞溶液,然后滴加盐酸,边滴边振荡。
溶液先变红后褪色,有气泡产生并出现浑浊
D
向盛有FeCl3溶液的试管中先加入足量锌粉,充分振荡后加2滴K3[Fe(CN)6]溶液
溶液黄色逐渐消失,加K3[Fe(CN)6]溶液产生深蓝色沉淀
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
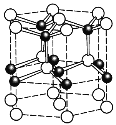
磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
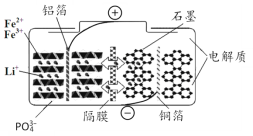
A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
难度: 困难查看答案及解析
-
常温下,用pH传感器进行数字化实验,分别向两个盛50mL 0.100mol/L 盐酸的烧杯中匀速滴加50mL 去离子水、50mL 0.100mol/L 醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间变化如下图所示。已知常温下醋酸铵溶液pH=7,下列说法错误的是
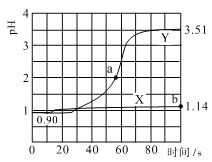
A.曲线X表示盐酸中加水稀释的pH变化
B.曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质
C.a点对应的溶液中c(Cl-)+c(CH3COO-)+c(CH3COOH)-c(NH4+)=0.01mol/L
D.b点对应的溶液中水电离的c(H+)=10-12.86mol/L
难度: 困难查看答案及解析
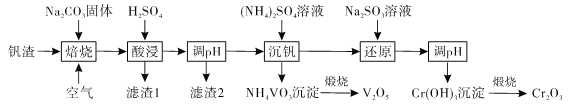
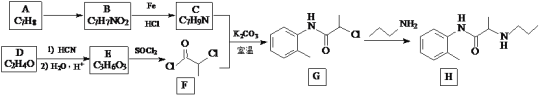
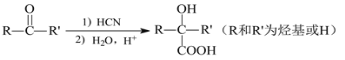
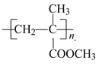 (聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线:________________。(无机试剂任选)
(聚甲基丙烯酸甲酯)是有机玻璃的主要成分,写出以丙酮和甲醇为原料制备聚甲基丙烯酸甲酯单体的合成路线:________________。(无机试剂任选)