-
常温下,将a L 0.1mol·L-1的NaOH溶液与b L 0.1mol·L-1的CH3COOH溶液混合,下列有关混合溶液的说法一定不正确的是( )
A.a<b时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.a=b时,c(CH3COOH)+c(H+)=c(OH-)
D.无论a、b有何关系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-)
难度: 中等查看答案及解析
-
已知常温下浓度均为0.1 mol·L-1的下列溶液的pH如表:
溶质
NaF
Na2CO3
NaClO
NaHCO3
pH
8.1
11.6
9.7
8.4
下列有关说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前 =N后
C.若将CO2通入0.1 mol·L-1 Na2CO3溶液至溶液呈中性则溶液中2c(CO32—)+c(HCO3—)=0.2 mol·L-1
D.向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF=CO2+H2O+2NaF
难度: 中等查看答案及解析
-
新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列不属于未来新能源的是( )
A.天然气 B.太阳能 C.生物质能 D.风能
难度: 简单查看答案及解析
-
改变下列条件,化学平衡一定会发生移动的是( )
A.浓度 B.压强 C.催化剂 D.温度
难度: 简单查看答案及解析
-
下列仪器使用前不需要检查是否漏水的是( )
A.分液漏斗 B.容量瓶 C.冷凝管 D.滴定管
难度: 简单查看答案及解析
-
已知某化学反应A2(g)+2B2(g)===2AB2(g)(AB2的分子结构为B—A—B)的能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应是放热反应
B. 该反应的ΔH=-(E1-E2) kJ· mol-1
C. 该反应中反应物的键能总和大于生成物的键能总和
D. 由2 mol A(g)和4 mol B(g)形成4 mol A—B键吸收E2 kJ能量
难度: 中等查看答案及解析
-
10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是( )
A.NaCl B.H2SO4 C.CuSO4 D.Na2CO3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.在稀溶液中,1 mol H2SO4(aq)与1 mol Ba(OH)2(aq)完全中和所放出的热量为中和热
B.表明参加反应物质的量和反应热的关系的化学方程式叫做热化学方程式
C.凡是在加热或点燃条件下进行的反应都是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
难度: 简单查看答案及解析
-
在298 K、100 kPa时,已知:2H2O(g)=O2(g)+2H2(g) ΔH1 Cl2(g)+H2(g)=2HCl(g) ΔH2 2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3,则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1-2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1+2ΔH2 D.ΔH3=ΔH1-ΔH2
难度: 简单查看答案及解析
-
M、N、P、E四种金属,已知:①M+N2+
N+M2+;②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为 E2++2e−
E,N−2e−
N2+。则这四种金属的还原性由强到弱的顺序是
A.P>M>N>E B.E>N>M>P
C.P>N>M>E D.E>P>M>N
难度: 中等查看答案及解析
-
如图所示,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( )

A.②①③④⑤⑥ B.⑤④②①③⑥ C.⑤④③①②⑥ D.⑤③②④①⑥
难度: 简单查看答案及解析
-
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A.该溶液的pH=4 B.升高温度,溶液的pH增大 C.此酸的电离平衡常数约为1×10-7 D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
难度: 中等查看答案及解析
-
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
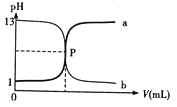
A.盐酸的物质的量浓度为 1mol/L
B.P点时反应恰好完全中和,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用做本实验的指示剂
难度: 困难查看答案及解析
-
有一化学平衡:mA(g)+nB(g)
pC(g)+qD(g)(如图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是( )

A.正反应吸热:m+n<p+q
B.正反应吸热:m+n>p+q
C.正反应放热:m+n>p+q
D.正反应放热:m+n<p+q
难度: 中等查看答案及解析
-
下图是可逆反应 A + 2B
2C + 3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断

A.若 A、B 是气体,则 D 是液体或固体
B.A、B、C、D均为气体
C.逆反应是放热反应
D.达平衡后,v(A)正 = 2v(C)逆
难度: 中等查看答案及解析
-
下列方程式书写正确的是( )
A.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++CO32-
B.H2S的电离方程式:H2S+H2O
H3O++HS-
C.CO32-的水解方程式:CO32-+2H2O
H2CO3+2OH-
D.HS-的水解方程式:HS-+H2O
S2-+H3O+
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.水解反应NH4++H2O
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
D.盐类水解反应的逆反应是中和反应
难度: 简单查看答案及解析
-
25 ℃时,5种银盐的溶度积常数(Ksp)如表所示,下列选项正确的是( )
AgCl
Ag2SO4
Ag2S
AgBr
AgI
1.8×10-10
1.4×10-5
6.3×10-50
5.0×10-13
8.3×10-17
A.AgCl、AgBr和AgI的溶解度依次增大
B.将Ag2SO4溶于水后,向其中加入少量Na2S溶液,不可能得到黑色沉淀
C.室温下,AgCl在水中的溶解度小于在食盐水中的溶解度
D.将浅黄色溴化银浸泡在饱和NaCl溶液中,会有少量白色固体生成
难度: 中等查看答案及解析
-
用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
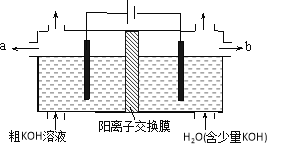
A.通电后阴极区附近溶液pH会增大
B.阳极反应式为4OH--4e-=2H2O+O2↑
C.纯净的KOH溶液从b出口导出
D.K+通过交换膜从阴极区移向阳极区
难度: 中等查看答案及解析