-
温家宝总理在全国人大会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是( )
A. 用“绿色化学”工艺,使原料完全转化为目标产物
B. 开发新能源,减少化石能源的使用,减少污染
C. 开发新型电池,推广废旧电池的回收、处理经验
D. 大量使用农药化肥,减少病虫害,提高粮食产量
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.乙烯的结构简式为:CH2CH2
B.丙烯的分子式为:C3H6
C.四氯化碳的电子式为:
D.丙烷的比例模型为:
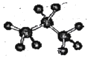
难度: 简单查看答案及解析
-
电离常数(Ka、Kb)、水解常数(Kh)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是( )
A.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)均变大
B.Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,氢氰酸的酸性比醋酸的强
C.向氯化钡溶液中加入等体积同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.水解常数的大小与温度、浓度有关,与溶液的酸碱性无关
难度: 简单查看答案及解析
-
对于常温下pH=2的醋酸溶液,下列叙述正确的是( )
A.由水电离产生的c(H+)=10-2mol/L
B.加水稀释时
增大
C.与pH=12的NaOH溶液等体积混合后,溶液呈中性
D.与pH=2的盐酸相比,醋酸中H+浓度更大
难度: 简单查看答案及解析
-
下列有关金属腐蚀与防护的说法不正确的是( )
A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e﹣═4OH﹣
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
难度: 简单查看答案及解析
-
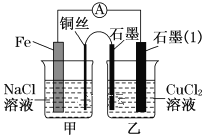
某小组为研究原电池原理,设计如图装置,下列叙述正确的是

A. 若X为Fe,Y为Cu,铁为正极
B. 若X为Fe,Y为Cu,电子由铜片流向铁片
C. 若X为Fe,Y为C,碳棒上有红色固体析出
D. 若X为Cu,Y为Zn,锌片发生还原反应
难度: 中等查看答案及解析
-
某溶液只含有NaCl和H2SO4两种溶质,它们的物质的量之比为3:1。用石墨作电极电解该混合溶液时,根据电解产物,可明显分为几个阶段。下列叙述不正确的是
A.阴极自始至终只析出氢气 B.阳极先析出Cl2,后析出O2
C.电解的最后阶段为电解水 D.溶液pH不断增大,最后pH=7
难度: 中等查看答案及解析
-
某温度下重水中存在电离平衡D2O
D++OD-,D2O的离子积常数=1.0×10-12,若pD=-lgc(D+),该温度下有关分析正确的是( )
A.0.1molNaOD溶于重水制成1L溶液,pD=13
B.将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6
C.pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol·L-1
D.向30mL0.5mol·L-1NaOD的重水溶液中加入20mL0.5mol·L-1 DCl的重水溶液,所得溶液pD=12
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.按系统命名法,
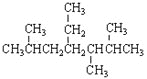 的名称为2,5,6-三甲基-4-乙基庚烷
的名称为2,5,6-三甲基-4-乙基庚烷B.常压下,正戊烷、异戊烷、新戊烷的沸点依次增大
C.乙烯可与溴水发生取代反应而使溴水褪色
D.
能发生加成反应、加聚反应
难度: 简单查看答案及解析
-
已知:25°C时,
,
。下列说法正确的是
A.25°C时,饱和
溶液与饱和
溶液相比,前者的
大
B.25°C时,在
的悬浊液加入少量的
固体,
增大
C.25°C时,
固体在20ml0.01 mol·
氨水中的
比在20mL0.01mol·
溶液中的
小
D.25°C时,在
的悬浊液加入
溶液后,
不可能转化成为
难度: 中等查看答案及解析
-
下列关于滴定操作的叙述,正确的是( )
A.若规格为25.00mL的滴定管中液面在5.00mL处,则液体全部流出时所得液体体积为20.00mL
B.用标准NaOH溶液滴定CH3COOH溶液时,可选用甲基橙作指示剂
C.用标准盐酸溶液滴定未知浓度NaOH溶液时,若滴定前滴定管尖嘴处有气泡未排出而滴定后消失,则能使所测结果偏高
D.滴定时眼睛一直注视滴定管中液面的变化情况
难度: 简单查看答案及解析
-
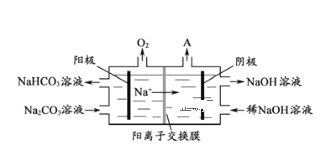
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )

A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-=Fe2+
C.甲中通入氧气的一极为阳极,发生的电极反应为O2+4e-+2H2O=4OH-
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
难度: 中等查看答案及解析
-
常温下分别向20.00 mL 0.1000 mol·L-1的氨水、醋酸铵溶液中滴加0.1000mol·L-1的盐酸,溶液pH与加入盐酸体积的变化关系如图所示。下列说法正确的是

A. M点溶液中c (OH-)>c(NH4+)>c(NH3·H2O)>c(H+)
B. N点溶液中c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)
C. P点溶液中c(NH4+)>2c(CH3COO-)+c(NH3·H2O)
D. Q点溶液中2c(Cl-)>c(CH3COOH)+c(NH4+)
难度: 困难查看答案及解析
-
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是( )

A.电池工作时H+移向负极
B.该电池用的电解质溶液是KOH溶液
C.甲电极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+
D.电池工作时,理论上每净化1 mol CO(NH2)2,消耗33.6 L O2
难度: 中等查看答案及解析
-
某烃的相对分子质量为72,分子中含有3个-CH3,则该结构的烃的二氯取代物最多可能有( )(不考虑立体异构)
A.11种 B.10种 C.9种 D.8种
难度: 简单查看答案及解析
-
电解NO制备NH4NO3的工作原理如图所示,X、Y均为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )

A.物质A为HNO3
B.X电极为阳极
C.利用该装置电解2molNO理论上可生成1.25molNH4NO3
D.Y电极反应式为NO-3e-+4OH-=NO3-+2H2O
难度: 中等查看答案及解析
-
1.01×105Pa,150℃时,将总体积为3L的C2H4、C2H6的混合气体与20L氧气混合并点燃,完全反应后氧气有剩余。当反应后的混合气体恢复至原条件时,气体体积为24L,原混合气体中C2H4、C2H6体积比为( )
A.1:1 B.1:2 C.2:1 D.2:3
难度: 中等查看答案及解析
-
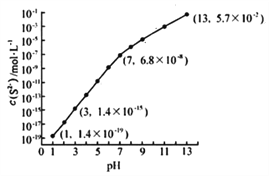
25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg
或lg
,下列叙述正确的是( )

A.曲线m表示pH与
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-6.4
D.25℃时,CO32-+H2O
HCO3-+OH-的平衡常数为1.0×10-5.7
难度: 中等查看答案及解析


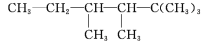 ,若C的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,写出C的该种同分异构体的结构简式___,用系统命名法命名为___。
,若C的一种同分异构体只能由一种烯烃加氢得到,且该烯烃是一个非常对称的分子构型,写出C的该种同分异构体的结构简式___,用系统命名法命名为___。