-
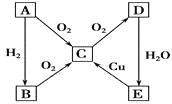
下列对古文献记载内容理解错误的是
A. 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐。
B. 《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏。
C. 《抱朴子·金丹篇》中记载:“丹砂烧之成水银,积变又还成丹砂”。该过程未发生氧化还原反应。
D. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应。
难度: 中等查看答案及解析
-
高一学生小强的化学笔记中有如下内容:
①纯净物按照元素组成可以分为单质和化合物
②单质又可分为金属和非金属
③化合物主要包括:酸、碱、盐和氧化物
④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体
⑤只要在水溶液中能导电的化合物就是电解质
⑥按照树状分类法可将化学反应分为:氧化还原反应和离子反应
⑦氧化还原反应的本质是化合价升降
你认为他的笔记中有几处错误( )
A.三处 B.四处 C.五处 D.六处
难度: 简单查看答案及解析
-
用氢氧化钠固体配制1.0 mol·L—1的溶液220mL,下列说法正确的是
A.用托盘天平称取氢氧化钠固体10g
B.配制时应选用250mL容量瓶
C.称量氢氧化钠固体时应在滤纸上称量
D.定容时仰视刻度线,所配溶液浓度偏高
难度: 中等查看答案及解析
-
下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生剧烈的反应
B.NaHCO3可用于制备纯碱,治疗胃酸过多的药剂、食品发酵剂
C.通过丁达尔效应可以鉴别豆浆和Fe(OH)3胶体
D.摩尔质量实际上就是该元素的相对原子质量
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.使石蕊呈红色的溶液:NH4+、Ba2+、ClO-、Cl-
C.使酚酞呈红色的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A.Na2O2与H2O反应制备O2:Na2O2+H2O=2 Na++2OH-+ O2↑
B.将氯气溶于水制备次氯酸:Cl2+H2O=2H+ + Cl-+ ClO-
C.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+= Cu2++2Fe2+
D.用浓盐酸酸化的KMnO4溶液与SO2反应,证明SO2具有还原性:2MnO4-+ SO2+2H2O=2Mn2+ +5 SO42-+4 H+
难度: 中等查看答案及解析
-
在同一条件下,体积相同的三个烧瓶中分别盛有NH3、HCl、NO2气体,并分别倒立在水槽中,充分反应后,烧瓶内三种溶液的物质的量浓度之比为(设烧瓶中的溶液未扩散到水槽里)( )
A.3:3:2 B.2:2:3 C.1:1:1 D.2:2:1
难度: 中等查看答案及解析
-
将0.4gNaOH和1.069
混合并配成溶液,向溶液中滴加0.1mol·
稀盐酸。下列图像能正确表示加入盐酸的体积和生成
的物质的量的关系的是
A.
 B.
B.
C.
 D.
D.
难度: 中等查看答案及解析
-
已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入a mol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/b mol•L﹣1 B. 2a/b mol•L﹣1 C. 3a/b mol•L﹣1 D. 5a/b mol•L﹣1
难度: 中等查看答案及解析
-
某气体的摩尔质量为M g·mol-1,分子数目为N,质量为m g,阿伏加德罗常数为NA,m(C)为C原子质量,下列各式所表示的意义的文字不正确的是
A.
表示该气体的物质的量
B.
表示该气体一个分子的质量
C.
表示该气体的相对分子质量
D.
表示该气体所含原子的质量
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应如下(反应条件忽略):3Fe2++ 2S2O32-+O2+xOH-= Fe3O4+ S4O62-+2H2O。下列说法不正确的是
A.每生成1mol Fe3O4,转移4mol电子
B.该反应中Fe2+和S2O32-都是还原剂
C.3mol Fe2+被氧化时有1molO2被还原
D.离子方程式中x=4
难度: 中等查看答案及解析
-
用氧化物的形式表示硅酸盐的组成,其中正确的是
A.钙沸石Ca(Al2Si3O10)·3H2O表示为Al2O3·CaO·3SiO2·3H2O
B.镁橄榄石Mg2SiO4表示为MgO·
SiO2
C.正长石KAlSi3O8表示为K2O·Al2O3·3SiO2
D.高岭石Al2(Si2O5)(OH)4表示为Al2O3·2SiO2·2H2O
难度: 简单查看答案及解析
-
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示。下列说法正确的是

A.a通入适量的CO2,b通入足量的NH3,纳米材料为Ca(HCO3)2
B.a通入足量的NH3,b通入适量的CO2,纳米材料为Ca(HCO3)2
C.a通入适量的CO2,b通入足量的NH3,纳米材料为CaCO3
D.a通入少量的NH3,b通入足量的CO2,纳米材料为CaCO3
难度: 简单查看答案及解析
-
X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是
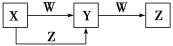
A.若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2
B.若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3
C.若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
D.若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3
难度: 困难查看答案及解析
-
某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )

A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水只有酸性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:湿润的有色布条褪色
难度: 简单查看答案及解析
-
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分【解析】
CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是:A.“另一种反应物”一定只具有氧化性
B.“另一种反应物”一定具有还原性
C.点燃时:2CuH+3Cl2=2CuCl2+2HCl
D.CuH 既可作氧化剂也可作还原剂
难度: 中等查看答案及解析
-
某无色混合气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下处理(假设每次处理均反应完全):①通过碱石灰,气体体积减小;② 通过灼热的氧化铜时,固体变为红色;③通过无水CuSO4粉末时,粉末变为蓝色;④ 通过澄清石灰水时,溶液变为浑浊。由此可以确定混合气体中
A.一定含有CO2、H2O蒸气,可能含有H2、CO
B.一定含有H2O蒸气、CO,可能含有CO2、H2
C.一定含有CO2、CO,可能含有H2O蒸气、H2
D.一定含有CO、H2,可能含有H2O蒸气、CO2中的1种或2种
难度: 中等查看答案及解析
-
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产全部是NO)。向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列叙述中正确的是
A.当生成沉淀达到最大值时,消耗NaOH溶液的体积一定为100mL
B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C.当金属全部溶解时收集到NO气体的体积为2.24L
D.参加反应的金属的总质量一定是6.6g
难度: 困难查看答案及解析