-
下列能源中不属于化石能源的是
A.煤 B.石油 C.天然气 D.潮汐
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.金刚石和石墨互为同位素
B.C2H6和C5H12 互为同系物
C.C2H4和C2H6互为同系物
D.CH3CH2CH2CH3和CH3CH(CH3)2 互为同系物
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.将氯气通入等物质的量溴化亚铁溶液:2Fe2++2Cl2+2Br-=2Fe3++4Cl-+Br2
B.钠与水的反应:Na+2H2O=Na++2OH-+H2↑
C.铜片跟稀硝酸的反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
D.金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
难度: 中等查看答案及解析
-
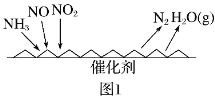
NO和CO都是汽车尾气中的物质,它们能很缓慢地反应生成N2和CO2,对此反应有关的叙述中不正确的是
A.降低压强能加快化学反应速率 B.使用适当催化剂可以加快化学反应速率
C.升高温度能加快化学反应速率 D.增大浓度可以加快此反应的速率
难度: 简单查看答案及解析
-
下列能确认化学平衡发生了移动的是
A.化学反应速率发生改变
B.有气态物质参加的可逆反应达到平衡后,改变压强
C.由于某一条件的改变,使平衡体系中反应物的转化率发生改变
D.可逆反应达到平衡后,使用催化剂
难度: 简单查看答案及解析
-
下列不能用勒夏特列原理解释的是( )
A.棕红色NO2加压后颜色先变深后变浅
B.Fe(SCN)3溶液中加入固体KSCN后颜色变深
C.氯水宜保存在低温、避光条件下
D.加催化剂,使氮气和氢气在一定条件下转化为氨气
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.苯、乙醇和乙酸都能发生取代反应
B.CH3CH2CH2CH3的二氯取代产物只有5种结构
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.使用溴的四氯化碳溶液或酸性KMnO4溶液都可以除去乙烷中混有的乙烯
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的电子层数和最外层电子数相同,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A.简单离子的半径大小:Y>W
B.元素W的最高价氧化物对应的水化物的酸性比Z的弱
C.单质Y和Z均能与强碱溶液反应生成氢气
D.W的气态氢化物稳定性强于X的气态氢化物
难度: 中等查看答案及解析
-
对于可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学平衡常数的表达式K=
B.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡状态
C.若达到平衡状态时两种反应物的转化率相等,则起始投入时n(NH3)∶n(O2)=4∶5
D.反应达到平衡状态后,改变条件使平衡向正反应方向移动,c(H2O)一定增大
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
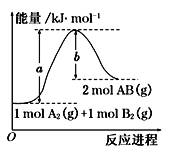
A.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B.每生成2 mol AB(g)吸收b kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热ΔH=+(a-b) kJ·mol-1
难度: 简单查看答案及解析
-
已知某可逆反应m A(g)+n B(g)
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
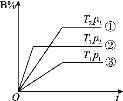
A.T1<T2 p1>p2 m+n>p 放热反应 B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应 D.T1>T2 p1<p2 m+n<p 吸热反应
难度: 简单查看答案及解析
-
容积固定的密闭容器中,达平衡的可逆反应2A(g)
2B(?) + C (?)(△H>0),若随着温度升高,气体平均相对分子质量减小,则下列判断正确的是:( )
A. B和C可能都是液体 B. B和C肯定都是气体
C. B和C可能都是固体 D. 若C为固体,则B一定是气体。
难度: 困难查看答案及解析
-
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:υ(H2)=0.45mol/(L·s),则2s末NH3的浓度为( )
A.0.50mol/L B.0.60mol/L C.0.45mol/L D.0.55mol/L
难度: 简单查看答案及解析
-
将BaO2放入密闭真空容器中,反应2BaO2(s)
2BaO(s) + O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.氧气的浓度增加 D.BaO2量增加
难度: 简单查看答案及解析
-
在一定条件下,向1L密闭容器中加入2 mol N2和7molH2,发生反应N2+3H2
2NH3,2分钟末时,测得剩余氮气为1mol,下列有关该反应的反应速率的描述中不正确的是( )。
A.υ(N2)= 0.5 mol/(L·min) B.υ(H2)= 1.5 mol/(L·min)
C.υ(NH3)= 1 mol/(L·min) D.υ(N2)=1mol/(L·min)
难度: 简单查看答案及解析
-
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)
2Z(g),各组分在不同时刻的浓度如下表:

下列说法正确的是
A.平衡时,X的转化率为20%
B.t ℃时,该反应的平衡常数为40
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
难度: 中等查看答案及解析
-
如图,甲容器有一个移动活塞,能使容器保持恒压。起始时,关闭活塞K,向甲中充入2mol SO2、1mol O2,向乙中充入4 mol SO2、2 mol O2。甲、乙的体积都为1 L(连通管体积忽略不计)。保持相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:2SO2(g)+O2(g)
2SO3(g)。达平衡时,甲的体积为0.8 L。下列说法正确的是
A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间,再次达到平衡,甲的体积为1.4 L
D.平衡后向甲中再充入2 mol SO2、1 mol O2和3 mol SO3,平衡向正反应方向移动
难度: 中等查看答案及解析
-
在一个1L的密闭容器中加2molA和1molB发生反应: 2A(g)+B(g)
3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是
A.6mol C+2mol D B.4mol A+2mol B
C.1mol A+0.5mol B+1.5mol C D.3mol C+5mol D
难度: 中等查看答案及解析
-
下列有关离子检验的操作和实验结论都正确的是
选项
实验操作及现象
实验结论
A
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解
该溶液中一定含有SO42-
B
向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体
原溶液中一定含有NH4+
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体
该溶液中一定含有CO32-
D
用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色
原溶液中不含K+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数如下表,下列有关叙述不正确的是
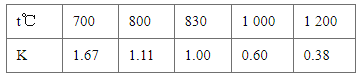
A.该反应的化学方程式是CO(g)+H2O(g)⇌CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式
=
,则此时的温度为1000 ℃
难度: 中等查看答案及解析