-
下列说法不正确的是( )
A.任何化学反应都伴随有能量变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.反应物的总能量低于生成物的总能量时,发生吸热反应
难度: 简单查看答案及解析
-
下列有关化学反应速率的理解正确的是( )
A.化学反应速率是指单位时间内任一种反应物浓度的减少或生成物浓度的增加
B.化学反应速率是指某一时刻,某种反应物的瞬时速率
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显
难度: 简单查看答案及解析
-
下列关于燃烧热的说法中正确的是( )
A.燃烧热是指1mol物质燃烧所放出的热量
B.燃烧热是指常温下,可燃物燃烧放出的热量
C.燃烧热是指1.01×105Pa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量
D.燃烧热随化学计量数的改变而改变
难度: 简单查看答案及解析
-
H2与O2发生反应的过程可用如图模型图表示(“—”表示化学键)。下列说法不正确的是( )
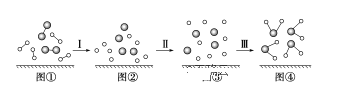
A.过程Ⅰ是吸热过程
B.过程Ⅲ一定是放热过程
C.该反应过程中所有旧化学键都断裂,且形成了新化学键
D.该反应的能量转化形式只能以热能的形式进行
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.自发反应在任何条件下都能实现
B.化学反应不一定都有能量变化
C.升高温度,活化分子百分数增大,化学反应速率一定增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率
难度: 简单查看答案及解析
-
已知反应4CO+2NO2
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A.v(CO)=1.5mol·L-1·min-1 B.v(NO2)=0.8mol·L-1·min-1
C.v(N2)=0.3mol·L-1·min-1 D.v(CO2)=1.1mol·L-1·min-1
难度: 简单查看答案及解析
-
在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
难度: 简单查看答案及解析
-
将4mol A气体和2mol B气体在2L密闭容器中混合,在一定条件下发生如下反应:2A(g)+B(g)
2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是( )
A.用物质A表示的反应速率为0.3mol·L-1·s-1
B.用物质B表示的反应速率为0.6mol·L-1·s-1
C.2s时物质A的浓度为0.7mol·L-1
D.2s时物质B的浓度为0.9mol·L-1
难度: 简单查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s)△H= —701.0kJ·mol-1 ,2Hg(l)+O2(g)=2HgO(s)△H= —181.6kJ·mol-1,则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为( )
A. -259.7 kJ·mol-1 B. +259.7 kJ·mol-1 C. +519.4kJ·mol-1 D. -519.4kJ·mol-1
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)=2HCl在光照和点燃条件下的△H不同
难度: 简单查看答案及解析
-
对处于平衡状态的反应2A(g)+B(g)
2C(g) ΔH <0,下列叙述正确的是( )
A.增大A浓度的瞬间,v(正)增大,v(逆)不变
B.升高温度,v(正)减小,v(逆)增大
C.减小压强,v(正)减小,v(逆)增大
D.降低温度,v(正)、v(逆)都增大
难度: 简单查看答案及解析
-
下列说法或表示方法不正确的是( )
A.盖斯定律实质上是能量守恒定律的体现
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨,s)=C(金刚石,s) ΔH= +1.9kJ/mol,可知石墨比金刚石稳定
D.已知H2(g)+Cl2(g)=2HCl(g) ΔH1= -184.6kJ/mol,则反应HCl(g)=
H2(g)+
Cl2(g)的ΔH= -92.3kJ/mol
难度: 简单查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
下列热化学方程式中ΔH表示可燃物燃烧热的是
A. CO(g)+1/2O2(g)=CO2(g) ΔH=-283 kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
D. H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1
难度: 简单查看答案及解析
-
在一密闭容器中充入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。
测定时刻/s
t1
t2
t3
t4
c(A)/(mol·L-1)
6
3
2
2
c(B)/(mol·L-1)
5
3.5
3
3
c(C)/(mol·L-1)
1
2.5
3
3
据此判断下列结论正确的是( )
A.在t3时刻反应已经停止
B.t1~t4时刻,A的转化率比B的转化率低
C.在容器中发生的反应为2A+B
2C
D.增大压强,达平衡时混合气体的平均相对分子质量增大
难度: 中等查看答案及解析