-
室温下,将碳酸钠溶液加热至70℃,其结果是( )
A. 溶液中c(CO32-)增大 B. 水的电离程度不变
C. 溶液的pH将变小 D. 溶液的碱性增强
难度: 简单查看答案及解析
-
中华文明源远流长,史书记载中蕴含着丰富的化学知识。下列说法不正确的是
A. 《本草纲目》记载“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中“碱”指的是K2CO3
B. 《易经》记载“泽中有火……上火下泽”,其描述的是CO在湖泊池沼水面上起火的现象
C. 《本草经集注》记载“强烧之,紫青烟起,云是真硝石也”,此法是利用焰色反应鉴别“硝石”
D. 《抱朴子》记载“丹砂(HgS)烧之成水银,积变又还成丹砂”,该过程为氧化还原反应
难度: 简单查看答案及解析
-
下列化学用语对事实的表述不正确的是( )
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
NH4++OH−
C. 由Na和C1形成离子键的过程:

D. 电解精炼铜的阴极反应:Cu2+ +2e−=Cu
难度: 中等查看答案及解析
-
关于化合物2−苯基丙烯(
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
难度: 中等查看答案及解析
-
Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是
A.负极反应式为Mg-2e-=Mg2+
B.正极反应式为Ag++e-=Ag
C.电池放电时Cl-由正极向负极迁移
D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑
难度: 中等查看答案及解析
-
反应C2H6(g)
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积 B. 升高反应温度
C. 分离出部分氢气 D. 等容下通入惰性气体
难度: 简单查看答案及解析
-
下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3
2Fe(OH)3+3MgCl2
难度: 中等查看答案及解析
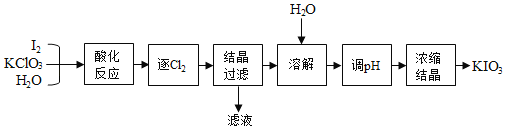
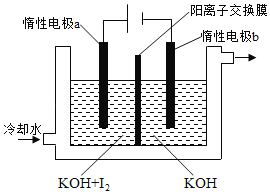
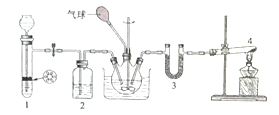
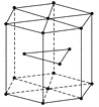
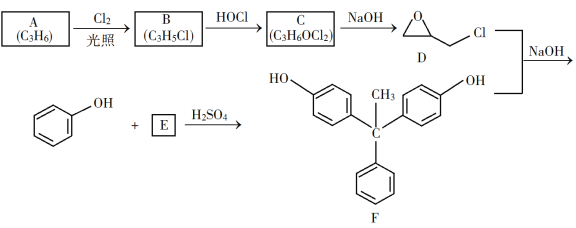
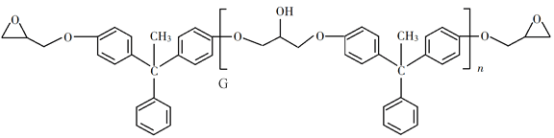
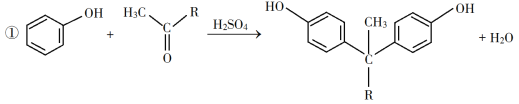

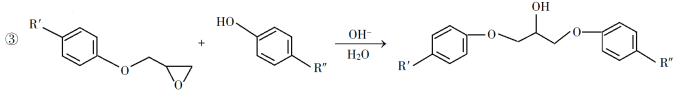 回答下列问题:
回答下列问题: