-
下列说法正确的是( )
A. 由于碘在酒精中的溶解度大,可以用酒精把碘水中的碘萃取出来
B. 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
C. 由于沙子是难溶于水的固体,因此可用过滤法分离沙子与水的混合物
D. 可以用冷却法从热的含少量KNO3的NaCl浓溶液中分离得到纯净的NaCl
难度: 中等查看答案及解析
-
下列实验操作中正确的是( )
A.四氯化碳萃取碘水中的碘在分液操作时,水从分液漏斗下口放出,碘的四氯化碳溶液从分液漏斗上口放出
B.进行蒸馏操作时,应使温度计水银球处于蒸馏烧瓶中溶液液面以下
C.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.进行蒸馏操作时,加热前应先通冷凝水,蒸馏结束后继续通冷凝水一段时间
难度: 中等查看答案及解析
-
下列电离方程式错误的是( )
①
②
③
④
⑤
A.①②④ B.②④⑤ C.①④⑤ D.③④⑤
难度: 简单查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A.碳酸钠溶液与石灰乳的反应:
B.氢氧化钡溶液与稀硫酸反应:
C.铜片插入硝酸银溶液:
D.硫酸铜溶液中滴加氢氧化钡溶液
难度: 简单查看答案及解析
-
NA代表阿伏加德常数,下列说法中正确的是( )。
A. 在同温同压时,相同体积的任何气体单质所含的原子数目相同
B. 2g氢气所含原子数目为NA
C. 在常温常压下,11.2 L氮气所含的原子数目为NA
D. 17g NH3所含电子数目为10NA
难度: 中等查看答案及解析
-
下列各组离子中,能在强酸性溶液里大量共存,并且溶液呈无色透明的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在标准状况下,将wg A气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
某溶液中,只含有下表中所示的四种离子,则X离子及其个数b可能为( )
离子
Na+
Al3+
Cl-
X
个数
3a
3a
2a
b
A.
、4a B.
、4a C.
、8a D.
、5a
难度: 中等查看答案及解析
-
a、b、c、d是HCl、BaCl2、AgNO3、Na2CO3四种溶液中的一种,现将它们两两混合,现象如下表所示:
反应物
a+b
a+c
b+c
c+d
b+d
现象
白色沉淀
白色沉淀
白色沉淀
白色沉淀
无色气体
由上述现象可推知a、b、c、d依次是
A. HCl、BaCl2、AgNO3、Na2CO3 B. AgNO3、HCl、Na2CO3、BaCl2
C. BaCl2、Na2CO3、AgNO3、HCl D. AgNO3、HCl、BaCl2、Na2CO3
难度: 中等查看答案及解析
-
把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A. (b-a)/V mol·L-1 B.(2b-a)/V mol·L-1
C.2(2b-a)/V mol·L-1 D.2(b-a)/V mol·L-1
难度: 中等查看答案及解析
-
下列图示的四种实验操作名称从左到右依次是( )
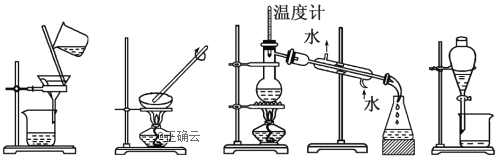
A.过滤、蒸发、蒸馏、分液 B.过滤、蒸馏、蒸发、分液
C.蒸发、蒸馏、过滤、分液 D.分液、蒸馏、蒸发、过滤
难度: 简单查看答案及解析
-
下列各选项中的两个反应,可用同一个离子方程式表示的是 ( )
选项
Ⅰ
Ⅱ
A
Ba(OH)2溶液与过量NaHCO3溶液混合
NaOH溶液与过量NaHCO3溶液混合
B
少量SO2通入Ba(OH)2溶液中
过量SO2通入Ba(OH)2溶液中
C
BaCl2溶液与Na2SO3溶液混合
Ba(OH)2溶液与H2SO3溶液混合
D
少量氨水滴入AlCl3溶液中
少量AlCl3溶液滴入氨水中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
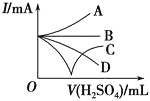
向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( )
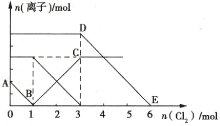
A.线段BC代表Cl-物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3
难度: 困难查看答案及解析
-
下列叙述正确的是
A. 在氧化还原反应中,一种元素被氧化的同时,肯定有另一种元素被还原
B. 元素由化合态变成游离态时,可能被氧化,也可能被还原
C. 失电子难的原子,获得电子的能力一定强
D. 有单质参加或生成的反应一定属于氧化还原反应
难度: 简单查看答案及解析
-
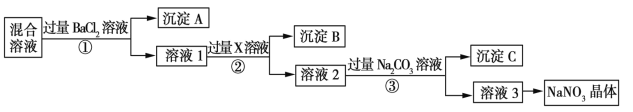
雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:
、
、
、
、
、
、
某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
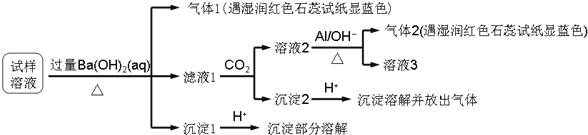
已知:
,根据以上的实验操作和现象,该同学得出的结论不正确的是
A.试样中肯定存在
、
、
和
B.试样中一定不含
C.试样中可能存在
、
D.该雾霾中可能存在
、
和
难度: 中等查看答案及解析
-
某无色溶液中只可能含有K+、Ag+、Ba2+、Cu2+、Cl-、OH-、CO32-、SO42-中的一种或几种,对其进行如下实验操作:
(1)取少量溶液,滴加无色酚酞试液,酚酞变红;
(2)另取少量溶液,加入足量BaCl2溶液,产生白色沉淀;
(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;
(4)将(3)所得混合物过滤,向滤液中加入AgNO3溶液,有白色沉淀生成。
下列对溶液的说法正确的是
A. 一定含有K+、OH-、CO32-、SO42- B. 可能含有Cl-、OH-
C. 一定不含有Ag+、Ba2+、Cu2+、Cl- D. 无法判断
难度: 中等查看答案及解析
-
下图中“—”表示相连的物质间在一定条件下可以发生反应,“→”表示丁在一定条件下可以转化为乙。下列选项中,符合图示要求的是( )
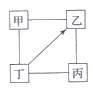
甲
乙
丙
丁
A
H2SO4
Na2SO4
NaOH
NaCl
B
KCl
K2CO3
KOH
HCl
C
O2
CO
CuO
C
D
Fe
CuCl2
Zn
H2SO4
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
两种硫酸溶液,一种硫酸溶液的物质的量浓度为
,密度为
;另一种硫酸溶液的物质的量浓度为c2,密度为
,将它们等体积混合后,所得溶液的密度为
,则混合后硫酸的物质的量浓度为( )
A.
B.
C.
D.
难度: 中等查看答案及解析