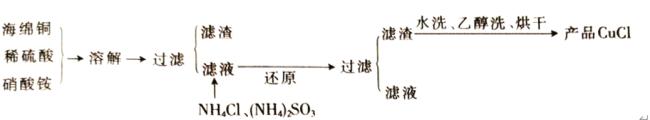
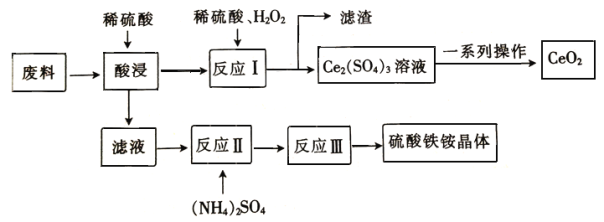
-
下列自然资源的开发利用过程中只涉及了物理变化的是
A.海水晒盐 B.伐薪烧炭 C.煤炭发电 D.刀耕火耨
难度: 简单查看答案及解析
-
下列表格中各项分类都正确的一组是
选项
纯净物
混合物
电解质
非电解质
A
生铁
黄铜
液态氯化氢
SO2
B
硫酸钠
水银
石墨
食盐水
C
洁净的空气
盐酸
CuSO4溶液
蔗糖
D
氢氧化钠
澄清石灰水
AgCl
CO
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
”生活无处不化学”.下列关于生活中的问题解释不合理的是
A.食盐不慎洒落在 天然气的火焰上,观察到黄色火焰,其原因:2Na+O2
Na2O2
B.沾水的铁制品器皿高温灼烧会发黑,其可能原因:3Fe+4H2O
Fe3O4+4H2
C.Al(OH)3可用于中和过多的胃酸,其原因:Al(OH)3+3HCl=AlCl3+3H2O
D.明矾可以净水,是因为明矾[KAl(SO4)2·H2O]溶于水能生成Al(OH)3胶体
难度: 简单查看答案及解析
-
根据离子反应发生的条件,判断下列各组物质中不能发生离子反应的是
A.H2SO4溶液与BaCl2溶液 B.NaOH溶液与CuSO4溶液
C.Na2CO3溶液与HNO3溶液 D.NaOH溶液与KCl溶液
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.用砂纸打磨过表面的铝箔,加热熔化后但不滴落,说明Al2O3的熔点比铝高
B.铝制品在生活中应用非常普遍,不因生锈而受损,故铝不活泼
C.铁在潮湿的空气中生成的氧化物结构不致密,不能保护内层金属,故铁制品往往涂保护层
D.钠与水的反应中,钠块熔成小球,说明该反应为放热反应
难度: 简单查看答案及解析
-
在配制溶液时,下列情况会使所配溶液浓度偏高的是
A.溶液转移到容量瓶中后,烧杯及玻璃棒未用蒸馏水洗涤
B.有些固体溶解会放热,未经冷却后立即将其转移至容量瓶中
C.定容时,仰视容量瓶的刻度线
D.定容后摇匀,发现液面降低,又补加少量蒸馏水至刻度线
难度: 简单查看答案及解析
-
下列关于铝和盐酸、NaOH溶液的反应说法不正确的是
A.等体积等浓度的盐酸、NaOH溶液分别与足量的铝反应消耗Al的物质的量之比为1:3
B.等体积等浓度的盐酸、NaOH溶液分别与足量的铝反应生成H2的物质的量之比为1:3
C.等质量的铝分别与足量的盐酸、NaOH溶液反应产生H2的物质的量之比为1:3
D.等质量的铝分别与足量的盐酸、NaOH溶液反应消耗酸和碱的物质的量之比为3:1
难度: 中等查看答案及解析
-
设阿伏伽德罗常数的值为NA,下列说法正确的是
A.1.0 mol·L-1的Na2CO3溶液中,Na+的数目为2NA
B.1.0 mol Na2O2与足量CO2成分反应,转移的电子数为2NA
C.标准状况下,2.24LCH3CH2OH分子中氢原子的数目为0.6NA
D.将0.1molH2和0.1molO2用电火花点燃,充分反应后,体系中所含氢原子总数为0.2 NA
难度: 简单查看答案及解析
-
将V1 mL 0.2 mol·L-1Na2CO3溶液加水稀释至V2 mL,稀释后溶液中的Na+物质的量浓度为
A.
mol·L-1 B.
mol·L-1 C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
下列应用或现象对应的离子方程式不正确的是
A.用FeCl3溶液腐蚀电路板上的铜:2Fe3++Cu=2Fe2++Cu2+
B.将FeCl3溶液加入滴有淀粉的KI溶液中,溶液变为蓝色:2Fe3++2I-=2Fe2++I2
C.往FeCl3溶液中通入H2S,产生淡黄色沉淀:H2S+ FeCl3=FeS↓+2H+
D.将KOH溶液加入FeCl3溶液中,产生红褐色沉淀:Fe3++3OH-=Fe(OH)3↓
难度: 简单查看答案及解析
-
下列实验或现象中的颜色变化,不涉及氧化还原反应的是
A
B
C
D
实验
用稀盐酸除去铜质器皿表面的铜绿[Cu2(OH)2CO3]
Na2O2放置在空气中
往FeCl3溶液中加入足量铁粉
将NaOH溶液滴入FeSO4溶液中
现象
铜质器皿表面呈红色,废液呈蓝色
固体粉末由黄色变为白色
溶液颜色由黄色变为浅绿色
产生白色沉淀,随后沉淀变为灰绿色,最后变为红褐色
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知还原性:H2SO3(SO2) >I->Fe2+>NO,据此判断下列反应不能发生的是
A.H2SO3+I2+H2O=2HI+ H2SO4 B.NO+SO3=NO2+SO2
C.2FeCl3+2HI= 2FeCl2+2HCl+I2 D.3 FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3) 3
难度: 中等查看答案及解析
-
31.04gFe3O4、Fe2O3、FeO组成的固体混合物,用180 mL6.0 mol·L-1盐酸能恰好将之完全溶解。若将此固体混合物用CO完全还原,则生成的铁的物质的量为
A.0.2mol B.0.3mol C.0.4mol D.0.5mol
难度: 困难查看答案及解析
-
高铁酸盐是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2
2Na2FeO4+ Na2O +2 Na2SO4+O2↑。若生成16.6g Na2FeO4,则反应中转移电子的物质的量为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
难度: 简单查看答案及解析
-
一定量的CO2与足量的Na2O2充分反应后,固体质量增加了8.4g,则消耗的CO2的物质的量为
A.0.2mol B.0.3mol C.0.6mol D.0.8mol
难度: 简单查看答案及解析
-
将200g质量分数为7.3%的盐酸,加入14.4g由Na2O2、 Na2CO3、 NaOH组成的混合物中,充分反应后,继续加入一定质量的氢氧化钠,反应至溶液巧合呈中性,蒸发结晶,最终得到的固体质量为
A.8g B.15.5g C.11.7g D.23.4g
难度: 中等查看答案及解析