-
下列说法正确的是( )
A. 同温同压下,相同数目的分子必具有相同的体积
B. 等质量的O2 和H2 的物质的量之比为l6:1
C. 不同的气体若体积不等,则它们所含的分子数一定不等
D. 同温同体积下,两种气体的物质的量之比等于压强之比
难度: 中等查看答案及解析
-
朱自清在《荷塘月色》冲写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的班驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 空气中的小水滴颗粒直径大小约为1nm--100nm
B. 空气中的小水滴颗粒的布朗运动
C. 雾是一种胶体,胶粒带相同电荷
D. 发生丁达尔效应
难度: 简单查看答案及解析
-
已知以下三个实验均能发生化学反应:①将铁钉放入硫酸铜溶液中;②向硫酸亚铁溶液中滴入几滴氯水;③将铜丝放入氯化铁溶液中。下列判断正确的是( )
A. 实验①中铁钉只做还原剂 B. 实验②中Fe2+既显氧化性又显还原性
C. 实验③中发生的是置换反应 D. 上述实验证明氧化性:Fe3+>Fe2+>Cu2+
难度: 困难查看答案及解析
-
分类是科学研究的重要方法,下列物质分类不正确的是
A. 化合物:干冰、冰水混合物、烧碱
B. 同素异形体:活性炭、C60、金刚石
C. 非电解质:乙醇、四氯化碳、氯气
D. 混合物:漂白粉、纯净矿泉水、盐酸
难度: 中等查看答案及解析
-
下列有关化学及人类社会发展历程的说法中,不正确的是( )
A.道尔顿的“原子论”和阿伏加德罗的“分子学说”对化学的发展起到了极大的推动作用
B.门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
C.人类历史上,重金属的发现和应用较早,而轻金属的发现和应用则较晚
D.化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器
难度: 简单查看答案及解析
-
下列化学用语或模型正确的是( )
A.氯化氢的电子式:
B.N2的结构式:N≡N
C.硫离子结构示意图:
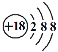
D.CH4分子的空间构型:三角锥形
难度: 简单查看答案及解析
-
某工厂排放的废水中含有氰化物,可在碱性条件下对氰化物进行净化处理:2CN-+8OH- +5C12=2CO2+N2+10Cl-+4H2O。下列分析中错误的是( )
A.当反应消耗0.2 mol CN-时,反应中转移电子的物质的量是1 mol
B.还原性:CN->Cl-
C.CN-的电子式为
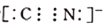
D.该反应中氧化剂和还原剂的物质的量之比是2∶5
难度: 困难查看答案及解析
-
下列反应对应的离子方程式书写正确的是( )
A.饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
B.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+SO42-+H+=BaSO4↓+H2O
C.碳酸氢钠溶液中加入稀盐酸:CO32-+2H+=CO2↑+H2O
D.澄清石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
难度: 简单查看答案及解析
-
2019年诺贝尔化学奖颁给几位在锂离子电池研发领域做出贡献的科学家,锂单质化学性质与钠类似,活泼性比钠略差。它的密度为0.534g/cm3,锂元素的焰色为紫红色,将绿豆大的锂投入水中,下列实验现象合理的有( )
①锂沉入水中 ②锂浮在水面上 ③水中有大量气泡 ④反应后在水中加入几滴石蕊试液,溶液变红 ⑤反应剧烈,发出紫红色火焰 ⑥锂四处游动
A.②⑥ B.①③ C.②③⑤ D.②④⑤⑥
难度: 简单查看答案及解析
-
科学家指出:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,它对人体是无毒的,吃饭时一定不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:“大量海鲜+大量维生素C→砒霜(As2O3,剧毒)”。下列有关解释正确的是( )
A.砒霜中毒后可服用维生素C解毒 B.青菜中含有维生素C,维生素C在反应中失电子
C.砒霜是该反应的氧化产物 D.维生素C能将+5价砷氧化成+3价
难度: 中等查看答案及解析
-
X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的简单气态氢化物水溶液显碱性,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质是黄绿色有毒气体。下列说法正确的是( )
A.Y元素氢化物的稳定性大于Z元素氢化物的稳定性
B.Y、Z、Q简单离子半径由大到小的顺序为Y>Z>Q
C.X、Y、M三种元素形成盐类化合物属于共价化合物
D.X、Z两元素形成的化合物中只含极性共价键
难度: 中等查看答案及解析
-
在“固体干冰→液体二氧化碳→气体二氧化碳→气体一氧化碳”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
难度: 简单查看答案及解析
-
下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A.标签上给出的离子的物理量是物质的量浓度
B.任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C.该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D.一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,14g有N2与CO组成的混合气体含有的原子数目为NA个
B.0.5molO3与11.2LO2所含的分子数一定相等
C.标准状况下,22.4L四氯化碳的分子数为NA
D.等物质的量的CO和CH4中碳原子数均为NA
难度: 中等查看答案及解析
-
测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的实验方案不合理的是( )
A.取ag混合物用酒精灯充分加热后质量减少bg
B.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加bg
C.取ag混合物与足量氢氧化钡溶液充分反应,过滤、洗涤、烘干,得bg固体
D.取ag混合物于锥形瓶中加水溶解,滴加一定浓度的盐酸溶液至混合物恰好反应完全,消耗盐酸VmL
难度: 困难查看答案及解析
-
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A.微粒X+和Y-的核外电子排布相同,则离子半径:X+<Y-
B.Cs和Ba分别位于第六周期I A和IIA族,则碱性:CsOH>Ba(OH)2
C.由水溶液的酸性:HCl>HF,可以推断出元素的非金属性:C1>F
D.Be与Al同处于同周期表金属与非金属交界处,可推出:Be(OH)2+2OH-=BeO22- +2H2O
难度: 困难查看答案及解析
-
最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:
Na2O + 2CO
Na2CO3 + C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
A.该生产石墨烯的反应属于氧化还原反应
B.石墨烯与金刚石互为同素异形体
C.Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
难度: 中等查看答案及解析
-
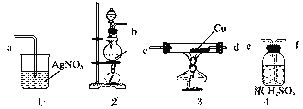
右图是一种实验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是( )
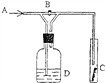
A. 浓H2SO4 B. 浓NaOH溶液
C. 饱和Na2SO4溶液 D. 石灰乳
难度: 困难查看答案及解析
-
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol·L﹣1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
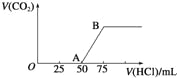
A.OA段所发生反应的离子方程式:H++OH﹣=H2O;CO32﹣+H+=HCO3-
B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1
C.产生的CO2体积(标准状况下)为0.056 L
D.原NaOH溶液的物质的量浓度为0.5 mol·L﹣1
难度: 中等查看答案及解析
-
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。下列说法正确的是( )

A.该硫酸的物质的量浓度为9.2mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL4.6mol·L-1的稀硫酸需取该硫酸50.0mL
D.实验室可用该硫酸制备氢气
难度: 中等查看答案及解析