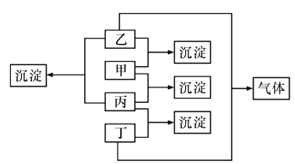
-
下列各组物质中,所含分子数目相同的是( )
A. 10g H2和10g O2 B. 2.8L N2(标准状况)和11g CO2
C. 9g H2O和0.5mol Br2 D. 224mL H2(标准状况)和0.1mol N2
难度: 简单查看答案及解析
-
下列离子方程式,书写正确的是( )
A. 盐酸与石灰石反应CO32-+H+ = CO2↑+H2O
B. 硫酸镁溶液中滴加氢氧化钡溶液Ba2++ SO42-= BaSO4↓
C. 氢氧化铁和盐酸反应:H++OH-=H2O
D. 氯化铁溶液和铜反应:2Fe3++Cu=2Fe2++Cu2+
难度: 简单查看答案及解析
-
下列各组离子在选项条件下一定能大量共存的是( )
A. 无色溶液:Na+、Cu2+、Cl-、NO3- B. 酸性溶液: NH4+、Fe3+、S2-、SO42-
C. 遇酚酞变红的溶液Na+、K+、SO42- 、NO3- D. 碱性溶液: K+、Al3+、SO42-、NO3-
难度: 简单查看答案及解析
-
下列各组反应,前后均可用同一离子方程式表示的是( )
A. HNO3+Na2CO3,HCl+NaHCO3 B. HNO3+Na2CO3,NaHSO4+K2CO3
C. HCl+NH3·H2O, H2S+KOH D. BaCl2+CuSO4,Ba(OH)2+NaHSO4
难度: 简单查看答案及解析
-
两位美国科学家彼得·阿格雷和罗德里克·麦金农,因为发现细胞膜水通道,以及对离子通道结构和机理研究作出的开创性贡献而获得2003年诺贝尔化学奖。他们之所以获得诺贝尔化学奖而不是生理学或医学奖是因为( )
A.他们的研究与化学物质水有关
B.他们的研究有利于研制针对一些神经系统疾病和心血管疾病的药物
C.他们的研究深入到分子、原子的层次
D.他们的研究没有深入到细胞的层次
难度: 简单查看答案及解析
-
下列有关氧化还原反应的叙述中正确的是 ( )
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.金属单质在化学反应中一定作还原剂
D.失电子的反应物在反应中作还原剂,反应中被还原
难度: 中等查看答案及解析
-
分类法在化学学习中具有重要意义,下列关于物质分类的正确组合是( )
碱
电解质
非电解质
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
NaHCO3
MgO
SO2
B
NaOH
Cu
NaCl
Na2O2
CO
C
Ba(OH)2
CH3COOH
Cl2
Na2O
NO
D
KOH
HNO3
SO2
CaO
SO3
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
真空碳热还原-氯化法可实现由铝土矿制备金属铝。其核心步骤反应为:Al2O3+3Cl2+3C = 2AlCl3 + 3CO。对于该反应下列说法不正确的是( )
A.Al2O3 为氧化剂 B.CO 为氧化产物 C.AlCl3 为还原产物 D.C 为还原剂
难度: 简单查看答案及解析
-
下列反应过程中溶液的导电性变化最为显著的是( )
A.向 NaOH 溶液中滴加相同浓度的盐酸至完全中和
B.向 Ba(OH)2 溶液中滴加相同浓度的盐酸至完全中和
C.向 Ba(OH)2 溶液中滴加相同浓度的稀硫酸至沉淀完全
D.向 BaCl2 溶液中滴加相同浓度的硝酸银溶液至沉淀完全
难度: 中等查看答案及解析
-
用 NA 表示阿伏加德罗常数的值,下列判断正确的是( )
A.标准状况下,22.4 L CCl4 含有的碳原子数是 NA
B.56 g Fe 与足量稀盐酸反应转移的电子数为 3 NA
C.0.1 mol/L Na2SO4 溶液含有的钠离子数为 0.2 NA
D.常温常压下,2g H2 中含有的分子数为 NA
难度: 中等查看答案及解析
-
下列反应中,水只做还原剂的是( )
A.2H2O
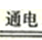 O2↑+2H2↑ B.2Na + 2H2O=2NaOH+ H2↑
O2↑+2H2↑ B.2Na + 2H2O=2NaOH+ H2↑C.CaO + H2OCa(OH)2 D.2F2 + 2H2O4HF+O2
难度: 简单查看答案及解析
-
把V L含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A. (b-a)/V mol·L-1 B.(2b-a)/V mol·L-1
C.2(2b-a)/V mol·L-1 D.2(b-a)/V mol·L-1
难度: 中等查看答案及解析
-
草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中.下列有关判断不正确的是( )
A. 草酸的摩尔质量是90g/mol B. 1mol草酸中含有6.02×1023个分子
C. 45g草酸中含有1.204×1024个氧原子 D. 1mol草酸在标准状况下的体积约为22.4L
难度: 简单查看答案及解析
-
现有两种硫酸溶液,其中一种物质的量浓度为C1 mol/L、密度为ρ1 g/cm3,另一种物质的量浓度为C2 mol/L、密度为p2 g/cm3 ,当它们等体积混合后,溶液的密度为ρ3 g/cm3,则混合溶液的物质的量浓度为( )
A.
B.
C.
D.
难度: 困难查看答案及解析
-
科学家发现了利用泪液来检测糖尿病的方法,其原理是用氯金酸钠(NaAuCl4)溶液与溶液中的葡萄糖发生反应生成纳米金单质颗粒(直径为20~60nm)。下列有关说法错误的是( )
A.纳米金单质颗粒能产生丁达尔效应
B.葡萄糖具有还原性
C.氯金酸钠中金元素的化合价为+ 3
D.检测时, NaAuCl4发生还原反应
难度: 简单查看答案及解析