-
《本草衍义》中有如下叙述:“嘉州峨眉山有燕萨石,形六棱而锐首,色莹白明澈。”这里“燕萨石”的主要成分可能是
A. CaO B. SiO2 C. 石墨 D. NaCl
难度: 中等查看答案及解析
-
据报道,某国一集团拟在太空建造巨大的集光装置,把太阳光变成激光用于分解海水制氢
2H2O=2H2↑+O2↑。下列说法正确的是( )
A. 水的分解反应是放热反应 B. 此反应是把化学能转化为热能而储存起来
C. 使用氢气作燃料有助于控制温室效应 D. 在这一反应中,热能转化为化学能
难度: 中等查看答案及解析
-
下列有关化学用语的表示正确的是
A.医用“钡餐”的化学式:BaCO3
B.C1-的结构示意图:
C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
D.N2的电子式:
难度: 简单查看答案及解析
-
化学与生产生活密切相关,下列有关说法不正确的是
A.大量使用含磷洗衣粉会造成生活污水的富营养化
B.用未经处理的电镀厂废水灌溉农田,易造成土壤重金属污染
C.臭氧-生物活性炭用于自来水深度处理,利用了活性炭的还原性
D.纳米铁粉可将地下水中的NO3-转化为N2,是因为纳米铁具有还原性
难度: 简单查看答案及解析
-
在指定分散系中可以大量共存的粒子组是:
A.在空气中:H2 、NH3、NO 、CO2
B.在K2CO3溶液中:Na+、H+、Cl-、Br-
C.在无水乙醇的CCl4溶液中:Br2、I2、苯、甲醇
D.在Fe(NO3)3溶液中:H+、SO42-、I-、K+
难度: 中等查看答案及解析
-
化学在生产和生活中有着广泛的应用。下列对应关系错误的是
选项
化学性质
实际应用
A
镁铝合金导热性能好
镁铝合金常用于制窗框
B
FeCl3的氧化性大于CuCl2
FeCl3溶液用于蚀刻铜制线路板
C
SO2具有还原性
海水制溴工业中用SO2的水溶液吸收Br2
D
铝易与氧结合且该反应放热
铝用于冶炼Cr、Mn等难熔金属
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
利用表中药品及图示装置不能制取的气体是
选项
制备气体
①
②
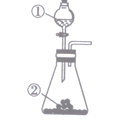
A
NH3
浓氨水
碱石灰
B
Cl2
浓盐酸
二氧化锰
C
NO2
浓硝酸
铜粉
D
SO2
浓硫酸
亚硫酸钠
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A.标准状况下,22.4LH2S与22.4LH2O中所含的分子数均为NA
B.由6.2gNa2O与7.8gNa2O2组成的混合物中阴离子总数为0.2NA
C.10g49%的硫酸与10g49%的H3PO4溶液中所含的氧原子数均为0.2NA
D.0.1molFe分别与足量的盐酸和氯气反应,转移的电子数均为0.2NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.氯气溶于水:Cl2+H2O
H++Cl-+HClO
B.MnO2与浓盐酸反应制Cl2:MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O
C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑
D.向NaHCO3溶液中加过量澄清石灰水:2HCO+Ca2++2OH-=CaCO3↓+CO
+2H2O
难度: 中等查看答案及解析
-
25℃、101kPa 下:
①2Na(s)+1/2O2(g)=Na2O(s) △H=-414kJ·mol-1
②2Na(s)+ O2(g)=Na2O2(s) △H=-511kJ·mol-1
下列说法正确的是 ( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa 下:Na2O2(s)+2 Na(s)= 2Na2O(s)△H =-317kJ/mol
难度: 中等查看答案及解析
-
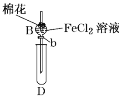
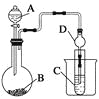
用海带灰制备碘单质的实验中,涉及的操作正确且能达到实验目的的是( )
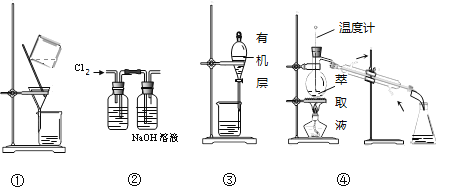
A.用图①所示装置,过滤海带灰浸取液
B.用图②所示装置,在滤液中通入Cl2
C.用图③所示装置,先放出下层液体,再放出有机层
D.用图④所示装置,回收萃取剂苯并获得单质碘
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍。下列说法正确的是
Y
Z
X
W
A.X的最高价氧化物可以直接和水化合生成相应的水合物
B.Z、W均可与Mg形成离子化合物
C.原子半径的大小顺序:r (Z)>r (Y)>r (X)
D.W的单质具有漂白性,能使干燥的有色布条褪色
难度: 中等查看答案及解析
-
下列实验现象中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
新制氯水中加入少量CaCO3
有气泡产生
酸性:HClO>H2CO3
B
向酸性KMnO4溶液中滴入待测液
溶液褪色
待测液中含Fe2+
C
铝箔插入稀硝酸中
无明显现象
铝箔表面形成了致密的氧化膜
D
向蔗糖中滴入浓硫酸
固体变黑,产生刺激性气体
浓硫酸具有脱水性和强氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键强弱无关的变化规律是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.F2、C12、Br2、I2的熔、沸点逐渐升高
D.Li、Na、K、Rb 的熔点逐渐降低
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述不正确的是
A.1mol甲醇分子中含有的共价键数为5NA
B.7.8g由Na2S和Na2O2组成的混合物中含有的离子总数为0.3 NA
C.加热条件下,20mL10mol·L-1浓硝酸与足量铜反应转移电子数为0.1 NA
D.在高温、高压和催化剂作用的条件下,向一密闭容器中充入28gN2与足量H2,充分反应后,转移的电子数小于6 NA
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,其中Y与Z为金属元素,四种元素的简单离子的电子层结构均相同。p、q是它们中的部分元素组成的化合物,r是W的单质,s是Z的单质。这些物质间的转化关系如图所示。下列说法不正确的是
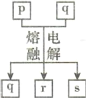
A.原子半径:Y>Z>W>X
B.q属于离子化合物
C.一定条件下,r与s能发生化合反应生成p
D.p能与盐酸反应,但不能与氢氧化钠溶液反应
难度: 中等查看答案及解析