-
下列物质分类正确的有几项
①混合物:铝热剂、氯水、水玻璃、漂白粉
②胶体:饱和氯化铁溶液、淀粉溶液、牛奶
③酸性氧化物:Mn2O7、SO2、SiO2、NO2
④同素异形体:C60、C70、金刚石、石墨
⑤电解质:BaSO4、NH3、NaOH、冰醋酸
⑥硅酸盐产品:水晶、水泥、陶瓷
⑦碱:苛性钠、纯碱、熟石灰 ⑧盐:胆矾、小苏打、铜绿
⑨放热反应:盐酸与氢氧化钠、碳与二氧化碳高温化合成一氧化碳、甲烷燃烧
A.2 B.3 C.5 D.6
难度: 中等查看答案及解析
-
NA表示阿伏加徳罗常数的值,下列有关叙述正确的为
A.1 mol铁粉在1 mol氧气中充分燃烧,失去的电子数为3NA
B.标况下,3.36 LSO3含有的电子数为6NA
C.4.2 g乙烯和丙烯混合气中含有的极性键数目为0.6NA
D.1L 1mol/L的葡萄糖溶液中,含有的分子数为NA
难度: 中等查看答案及解析
-
CO和H2在ThNi5作用下可以合成CH4。
已知温度为T时:① CO(g)+H2O(g) === CO2(g)+H2(g) ΔH=-41 kJ·mol-1
② CH4(g)+2H2O(g) === 4H2(g) + CO2(g) ΔH=+165 kJ·mol-1
下列说法不正确的是
A.催化剂不能改变该反应的ΔH
B.①中反应物的键能总和小于生成物的键能总和
C.②中反应物的总能量高于生成物的总能量
D.CO(g)与H2(g)合成CH4(g)的反应为放热反应
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.2.24LCO2通入250 mL 0.5 mol/L的 NaOH溶液中:4CO2+5OH-=CO32-+3HCO3-+H2O
B.在100 mL 2 mol/L的FeI2的溶液中通入标准状况下5.6 L的Cl2:4Fe2++6I-+5Cl2=4Fe3++3I2+10Cl-
C.100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32- +2 CH3COOH=H2O+CO2↑+ CH3COO-
D.4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2- + 7H+ + H2O=3Al(OH)3↓+ Al3+
难度: 困难查看答案及解析
-
在某种接近中性的含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-6种离子中的几种。
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向呈橙黄色的溶液中滴加BaCl2时无沉淀生成;
③橙黄色溶液不能使淀粉变蓝。则上述溶液中一定不存在的离子是 ( )
A.NH4+、Br-、CO32- B.NH4+、I-、SO32-
C.Fe2+、I-、SO32- D.Fe2+、Br-、CO32-
难度: 困难查看答案及解析
-
“化学实验→观察现象→分析推理→得出结论”是化学学习的方法之一。下列说法正确的是( )
A.证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉-KI 试纸检验,观察试纸颜色变化
B.将SO2通入足量稀Fe(NO3)3溶液,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2∶3
C.验证淀粉的水解产物是否具有还原性,取水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
D.向铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色褪去,该过程中发生的反应为 2Al+3Ag2S=6Ag+Al2S3
难度: 中等查看答案及解析
-
将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是
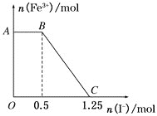
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
难度: 中等查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
A.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、SO32-、AlO2-
B.含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.含等物质的量的Ba(OH)2、NaAlO2、KOH的溶液中,缓慢通入CO2:Ba(OH)2、KOH、NaAlO2、K2CO3、BaCO3
D.在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+
难度: 困难查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有平衡:Br2+H2O
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.对CO(g) + NO2 (g)
CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深
C.高压比常压有利于合成SO3的反应
D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
难度: 中等查看答案及解析
-
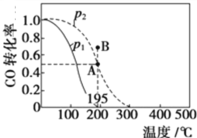
在一定温度下,只改变反应物中n(SO2)对反应2SO2(g)+O2(g)⇌2SO3(g)的影响如图所示,下列说法正确的是( )
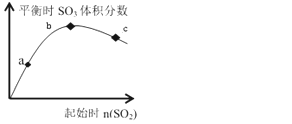
A. 反应a、b、c点均为平衡点,且b点时SO2的转化率最高
B. b点时SO2与O2 的物质的之比约为2:1
C. a、b、c 三点平衡常数: Kb>Kc>Ka
D. a、b、c 三点反应速率大小为: vb>vc>va
难度: 中等查看答案及解析
-
在一个绝热定容的密闭容器中,1molA与2molB发生反应A(g)+2B(g)
xC(g)+2D(g) △H=bkJ·mol−1(b<0),下列说法不正确的是
A.平衡时,A和B的转化率相等
B.若 x=1,容器中压强不变时不能判断反应达到平衡
C.当B和D的物质的量之比1:1不变时,表明该反应已达到平衡
D.达到平衡过程中,正反应速率可能是先增大再减小
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
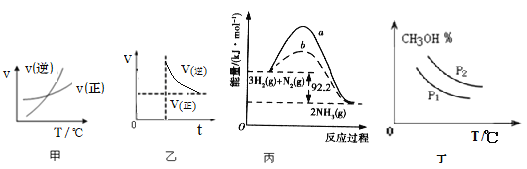
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示反应NH2COONH4(s)
2NH3(g)+CO2(g)达到平衡后,增大压强,反应速率和时间的关系,达到新平衡后,氨气浓度不变,压强也不变
C.图丙向容器中充入 1 mol N2、3 mol H2,充分反应后放出热量 92.2 kJ
D.图丁可表示在不同压强P1、P2(P1>P2)条件下CO(g)+2H2(g)
CH3OH(g) △H<0,甲醇百分含量随温度变化的情况
难度: 中等查看答案及解析
-
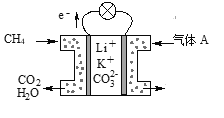
如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)。下列有关说法正确的是
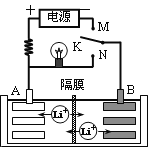
A.该电池的总反应式为Li1-xMnO2+LixC6
LiMnO2+C6
B.K与M相接时,A是阴极,发生还原反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充、放电过程中至少存在3种形式的能量转化
难度: 困难查看答案及解析
-
短周期元素A、B、C、D 原子序数依次增加,X、Y、Z、W是由这四种元素中的两种元素组成的常见化合物,X为有刺激性气味的气体,Y为淡黄色固体,甲是由C元素形成的气体单质,乙为红棕色气体,上述物质之间的转化关系如图所示
部分反应物或生成物省略
。下列说法不正确的是
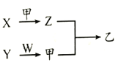
A.离子半径大小顺序:B>C>D>A
B.最简单气态氢化物的稳定性:B>C
C.图示转化关系涉及的反应均为氧化还原反应
D.元素C、D形成的化合物中一定含离子键
难度: 困难查看答案及解析
-
钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求。一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3+2Na2NiFeII(CN)6
Na3Ti2(PO4)3+2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是
A.放电时NaTi2(PO4)3在正极发生还原反应
B.放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中
C.充电过程中阳极反应式为:2NaNiFeIII(CN)6+2Na++2e-=2Na2NiFeII(CN)6
D.该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变
难度: 困难查看答案及解析
-
应用元素周期律的有关知识进行的下列预测中,正确的有几个
①Be的最高价氧化物对应的水化物具有两性
②Tl(铊)与盐酸和NaOH溶液作用均能产生氢气
③At的单质为有色固体,AgAt不溶于水也不溶于稀硝酸
④Li在氧气中剧烈燃烧的产物为Li2O2
⑤SrSO4(硫酸锶)是难溶于水的白色固体
⑥H2Se是无色、有毒、比H2S稳定的气体
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
下列涉及有机物的说法中正确的是
A.乙烯、氯乙烯都是不饱和烃,均可用于合成有机高分子材料
B.煤的干馏可得到煤焦油,煤焦油蒸馏可得到苯、甲苯等芳香烃
C.在加热条件下,加入适量生石灰以除去乙酸乙酯中含有的乙醇杂质
D.淀粉和纤维素的水解产物都是葡萄糖,二者互为同分异构体
难度: 中等查看答案及解析
-
食品、大气、工业尾气中SO2均需严格检测或转化吸收,下列有关SO2的检测或吸收方法正确的是
A.滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度
B.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
C.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中SO2的浓度
D.石灰—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用于生产石膏
难度: 中等查看答案及解析
-
下列说法不正确的是
A.25℃时将10mLpH=11的氨水加水稀释至100mL时氨水的浓度是0.01mol/L(氨水的Kb=1×10-5)
B.室温下向10mLpH=3的醋酸溶液中加水稀释,溶液中
不变
C.现有浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,分别用以上三种酸溶液中和一定量的NaOH溶液,反应后溶液呈中性,需要酸溶液的体积分别为V1、V2、V3,其大小关系为V3> V1> V2
D.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多,说明盐酸是强酸,醋酸是弱酸
难度: 中等查看答案及解析
-
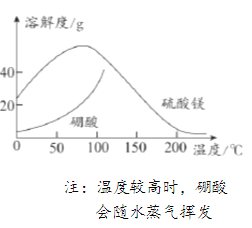
下列图示与对应的叙述不相符的是
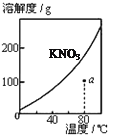
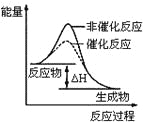
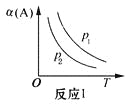
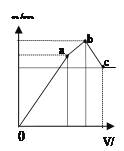
图1 图2 图3 图4
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示反应aA(g)+bB(g)
cC(g)表示改变某一条件对化学平衡的影响, 若p1>p2此反应自发进行,必须满足的条件是低温
D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化
难度: 中等查看答案及解析