-
A是一种红棕色金属氧化物,B、G是金属单质,F是一种难溶于水的白色化合物,受热后容易发生分解。
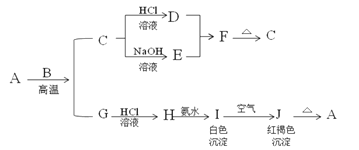
(1)写出下列物质的化学式:A:___ E:___ F:___ H:__。
(2)按要求写方程式:
①H与氨水反应的离子方程式:___。
②B与氢氧化钠溶液反应的离子方程式:___。
③I在空气中转化为J的化学方程式:___。
难度: 中等查看答案及解析
化学与社会、生活密切相关,下列说法错误的是( )
A.可在水中加入明矾来净化水
B.可在豆浆中加入石膏制作豆腐
C.可用氢氧化铝中和过多胃酸
D.可用二氧化硅作太阳能电池的材料
难度: 简单查看答案及解析
下列实验操作中正确的是( )
A.过滤操作时,用玻璃棒搅拌漏斗内的液体,以加速过滤
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,可以选用酒精作为萃取剂从碘水中萃取碘
难度: 简单查看答案及解析
下列关于胶体的说法中,不正确的是( )
A.分散质粒子直径在10-9~10-7 m之间
B.Fe(OH)3胶体比NaOH溶液更加稳定
C.当光束通过Fe(OH)3胶体时,能看到一条光亮的“通路”
D.向沸水中逐滴加入FeCl3饱和溶液,煮沸至红褐色即得Fe(OH)3胶体
难度: 简单查看答案及解析
我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4═Cu+FeSO4。有关该反应的说法正确的是( )
A.Fe是氧化剂 B.氧化性:Fe>Cu
C.当生成32gCu时转移1mol电子 D.CuSO4发生氧化反应
难度: 简单查看答案及解析
以NA表示阿伏伽德罗常数,下列说法中正确的是( )
A.物质的量浓度为0.1mol/L的NaOH溶液中Na+数为0.1NA
B.22.4LO2中含有分中子数为NA
C.9gH2O所含有的氢原子数目为NA
D.1molO3的质量是48g·mol-1
难度: 简单查看答案及解析
下列离子方程式中正确的是( )
A.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
B.盐酸与AgNO3溶液反应:HCl+Ag+=AgCl↓+H+
C.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
难度: 简单查看答案及解析
下列各物质的分类、名称(或俗名)、化学式中不能完全对应的是( )
A.碱性氧化物、过氧化钠、Na2O2
B.酸性氧化物、三氧化硫、SO3
C.正盐、苏打、Na2CO3
D.含氧酸、次氯酸、HClO
难度: 简单查看答案及解析
在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、NO3-、Cl-、Fe2+
B.K+、CO32-、Ca2+、NO3-
C.K+、SO42-、Al3+、Cl-
D.Ca2+、Cl-、K+、AlO2-
难度: 简单查看答案及解析
下列物质中,属于电解质且能导电的是( )
A.固体氯化钠
B.硫酸溶液
C.铁片
D.熔融的氢氧化钠
难度: 简单查看答案及解析
将钠粒投入装有水的烧杯中发生反应,通过观察实验现象不能直接证明的是( )
A.钠的熔点较低
B.钠与水反应生成氢氧化钠
C.反应产生气体
D.钠的密度比水小
难度: 简单查看答案及解析
下列物质的性质与应用关系的描述正确的是( )
A.氧化铝的熔点高,可用作耐火材料
B.氢氧化钠固体具有吸水性,可用作所有气体的干燥剂
C.氯气有强氧化性,可用氯气漂白干燥有色布条
D.碳酸氢钠能与酸作用,可用其治疗胃溃疡
难度: 简单查看答案及解析
提纯下列物质(括号内物质为杂质),选用的试剂和方法都正确的是( )
| 物质 | 除杂试剂 | 方法 | |
| A | CO2(SO2) | 饱和NaHCO3溶液 | 洗气 |
| B | FeCl2溶液(FeCl3) | 足量Cl2 | — |
| C | Na2CO3固体(NaHCO3) | 足量NaOH溶液 | 加热 |
| D | Al粉(Zn) | 足量NaOH溶液 | 过滤 |
A.A B.B C.C D.D
难度: 简单查看答案及解析
以Al2O3原料制取氢氧化铝,最好的方法是( )
①将Al2O3先溶于NaOH溶液中,再通入过量的CO2
②将Al2O3先溶于盐酸中,再滴加过量的氢氧化钠溶液
③将Al2O3先溶于盐酸中,再滴加过量的氨水
④将Al2O3先溶于NaOH溶液中,再滴加过量的盐酸
A.①② B.②④ C.①③ D.③④
难度: 简单查看答案及解析
下面关于硅及其化合物的叙述中,不正确的是( )
A.可用氢氟酸在玻璃上雕刻花纹
B.玻璃、陶瓷、水泥都属于传统的硅酸盐产品
C.硅胶可用作食品干燥剂
D.硅元素化学性质不活泼,在自然界中可以游离态形式存在
难度: 简单查看答案及解析
为检验溶液里的某种离子,进行下列实验,其中结论正确的是( )
A.某溶液进行焰色反应为黄色,则该溶液中一定含有Na+,一定没有K+
B.先滴加KSCN溶液无明显现象,再滴加氯水显红色,证明某溶液中含有Fe2+
C.加AgNO3溶液有白色沉淀生成,再加稀盐酸沉淀不溶解,溶液一定含Cl-
D.加入稀HCl,产生使澄清石灰水变浑浊的无色气体,则溶液中一定含CO32-
难度: 简单查看答案及解析
下列有关说法正确的是( )
A.油罐车上所贴危险化学品标志是易燃液体标志
B.浓硫酸沾到皮肤上应立即用大量水冲洗,再涂抹氢氧化钠溶液
C.用容量瓶配制溶液时,若不慎加水超过刻度线,立即用胶头滴管吸出多余液体
D.稀释浓硫酸时,将水沿烧杯内壁倒入浓硫酸中,并用玻璃棒不断搅拌
难度: 简单查看答案及解析
A是一种红棕色金属氧化物,B、G是金属单质,F是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学式:A:___ E:___ F:___ H:__。
(2)按要求写方程式:
①H与氨水反应的离子方程式:___。
②B与氢氧化钠溶液反应的离子方程式:___。
③I在空气中转化为J的化学方程式:___。
难度: 中等查看答案及解析
根据题意完成下列各小题。
(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.结晶法 B.过滤法 C.蒸馏法 D.分液法
①___分离饱和食盐水和沙子的混合物。
②___从硝酸钾和氯化钠的混合溶液中获得硝酸钾(溶解度差异很大)。
③___分离酒精和水的混合物。
④___分离植物油和水。
(2)过氧化钠可作供氧剂,理由是___(用化学方程式表示);
(3)关于碳酸钠和碳酸氢钠的性质:
①热稳定性:Na2CO3___NaHCO3(填“﹥”或“﹤”或“=”,下同)。
②相同条件下,在水中的溶解性:Na2CO3___NaHCO3。
③相同条件下,水溶液碱性:Na2CO3___NaHCO3。
④相同物质的量浓度的Na2CO3与NaHCO3溶液分别与同浓度的盐酸反应,产生气体的速率Na2CO3___NaHCO3。
⑤写出NaHCO3溶液与稀盐酸反应的离子方程式:___。
难度: 简单查看答案及解析
实验室制备并收集干燥、纯净氯气的装置如图所示:

(1)写出实验室制备Cl2的化学方程式:___。
(2)写出指定试剂的名称,C__,D__。
(3)C的作用是__,D的作用是__,F的作用是___。
(4)检验氯气是否收集满的操作:___。
(5)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,其中该反应中HCl的作用是___,若反应产生0.5mol Cl2,则消耗的氧化剂的物质的量为___mol,反应转移的电子数是___。
难度: 简单查看答案及解析
某中学化学课外兴趣小组通过实验探究Fe2+、Fe3+的性质。回答下列问题:
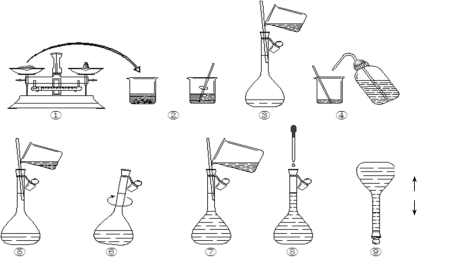
(1)本次实验中共需要1mol/LFeCl2溶液100 mL,配制时涉及到如下操作:
①步骤③中玻璃棒的作用是__;
②在配制溶液过程中步骤⑦所进行的操作是___(填“洗涤”、“转移”、“定容”);该步中视线应与溶液凹液面的最低处保持___。
③下列操作会使所配溶液物质的量浓度偏低的是___。
A.溶解后小烧杯、玻璃棒没有洗涤
B.所用容量瓶中,已有少量蒸馏水
C.定容、加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度线
(2)取2mLFeCl2溶液于试管中,加入几滴氯水,再加入1滴KSCN溶液,观察到的现象为__,说明Cl2可将Fe2+氧化成Fe3+。FeCl2溶液与氯水反应的离子方程式为___,此时将所取FeCl2溶液完全反应需__molCl2。
(3)在(2)溶液中加入过量的铁粉,溶液变成___色;发生反应的离子方程式为__,此时溶液中所含铁元素的微粒的物质的量为__mol。
难度: 中等查看答案及解析