-
下列说法正确的是( )
A. 反应物分子的每次碰撞都能发生化学反应
B. 活化分子之间的碰撞一定是有效碰撞
C. 能够发生化学反应的碰撞是有效碰撞
D. 增大反应物浓度时,活化分子百分数增大
难度: 中等查看答案及解析
-
下列说法不正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需加热就能发生
C.需要加热才能发生的反应不一定是吸热反应
D.化学反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对高低
难度: 简单查看答案及解析
-
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
难度: 中等查看答案及解析
-
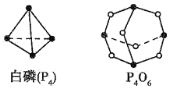
下列图像分别表示有关反应的反应过程与能量变化的关系,其中判断正确的是( )
A.
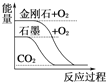 石墨转变成金刚石是吸热反应
石墨转变成金刚石是吸热反应B.
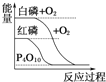 白磷比红磷稳定
白磷比红磷稳定C.
 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0D.
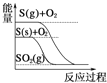 S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2
S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2,则ΔH1>ΔH2难度: 中等查看答案及解析
-
化学与社会可持续发展密切相关。下列做法错误的是
A. 按照国家规定,对生活垃圾进行分类放置
B. 工业废水经过静置、过滤后排放,符合绿色化学理念
C. 植物的秸秆、枝叶和人畜粪便等生物质能可转化为沼气
D. 氢气是一种有待大量开发的“绿色能源”
难度: 简单查看答案及解析
-
在2A(g)+3B(g)
C(g)+4D(g)反应中,表示该反应速率最快的是( )
A.v(A)=0.4mol/(L·s) B.v(B)=0.3mol/(L· s)
C.v(C)=0.15mol/(L·s) D.v(D)=0.5mol/(L·s)
难度: 简单查看答案及解析
-
某同学按照课本实验要求,用50mL0.50mol/L的盐酸于50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热,下列说法中,正确的是( )
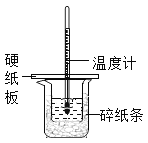
A. 烧杯间填满碎纸条的作用是固定小烧杯
B. 用如图装置可以完成中和热测定的实验
C. 为防止混合溶液时溅出产生误差,因此混合时速度要慢
D. 若将盐酸体积改为60mL,不考虑热量损失,理论上所求中和热相等
难度: 中等查看答案及解析
-
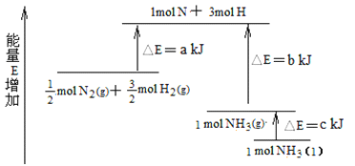
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H = -38.6kJ·mol-1
C.HCl和NaOH 反应的中和热△H= -57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的热化学方程式为:H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) △H=-114.6kJ·mol -1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(1) △H =-571.6kJ·mol-1
难度: 中等查看答案及解析
-
如图所示,反应:X(气)+3Y(气)
2Z(气);△H<0,在不同温度、不同压强下(p1>p2),达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为:
A.
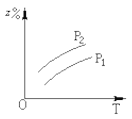 B.
B. 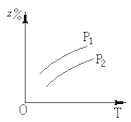 C.
C. 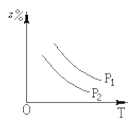 D.
D. 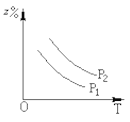
难度: 中等查看答案及解析
-
容积相同的甲、乙两个容器,分别充有等物质的量的SO2和O2,在相同温度下发生反应2SO2(g)+O2(g)
2SO3(g) ,并达到平衡,在此过程中,甲容器保持容积不变,乙容器保持压强不变,若甲容器中SO2的转化率为α,则乙容器中SO2的转化率为( )
A.等于α B.大于α C.小于α D.无法判断
难度: 中等查看答案及解析
-
已知某可逆反应:mA(g)+nB(g)
xC(g) ΔΗ=Q kJ•mol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
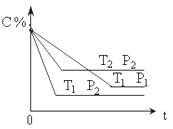
A.T1>T2,P1>P2,m+n>x,Q>0 B.T1<T2,P1<P2,m+n<x,Q>0
C.T1>T2,P1<P2,m+n<x,Q<0 D.T1<T2,P1<P2,m+n>x,Q<0
难度: 中等查看答案及解析
-
在密闭容器中,反应xA(g)+yB(g)
zC(g)达平衡时,A的浓度为0.5mol/L。若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
A.x+y<z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
难度: 中等查看答案及解析
-
一定温度下,在3个1.0 L的恒容密闭容器中分别进行反应2X(g)+Y(g)
Z(g) ΔH,达到平衡。相关数据如下表。
容器
温度/K
物质的起始浓度/ mol·L-1
物质的平衡浓度/ mol·L-1
c(X)
c(Y)
c(Z)
c(Z)
I
400
0.20
0.10
0
0.080
II
400
0.40
0.20
0
a
III
500
0.20
0.10
0
0.025
下列说法不正确的是
A. 平衡时,X的转化率:II>I
B. 平衡常数:K(II)>K(I)
C. 达到平衡所需时间:III<I
D. 反应的ΔH<0
难度: 中等查看答案及解析
-
在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+
O2(g)=SO2(g)+H2O(g) △H1
②2H2S(g)+SO2(g)=
S2(g)+2H2O(g) △H2
③H2S(g)+
O2(g)=S(g)+H2O(g) △H3
④2S(g) =S2(g) △H4
则△H4的正确表达式为( )
A.△H4=2/3(△H1+△H2-3△H3)
B.△H4=2/3(3△H3-△H1-△H2)
C.△H4=3/2(△H1+△H2-3△H3)
D.△H4=3/2(△H1-△H2-3△H3)
难度: 中等查看答案及解析
-
在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A.x=4 B.2 min内B的反应速率为0.1 mol·(L·min)-1
C.混合气体密度不变,则表明该反应已达到平衡状态 D.B的转化率为40%
难度: 困难查看答案及解析
-
下列说法正确的是
A.二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
B.氯化钠溶液在电流作用下完全电离成钠离子和氯离子
C.硫酸钡难溶于水,但硫酸钡属于强电解质
D.弱电解质的电离平衡常数与浓度、温度等条件有关
难度: 简单查看答案及解析
-
下列电离方程式中,正确的是( )
A.HClO=H++ClO- B.H2SO4
2H++SO42-
C.H2S
2H++S2- D.NH4NO3=NH4++NO3-
难度: 简单查看答案及解析
-
向0.1 mol·L-1醋酸溶液中逐滴加入氨水至过量时,溶液的导电能力将发生相应的变化,其电流强度(I)随加入氨水的体积(V)变化的曲线关系是下图中的
A.
B.
C.
D.
难度: 中等查看答案及解析