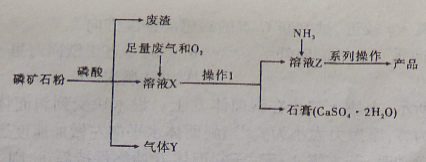
-
我国京津冀地区部分城市常出现雾霾,其主要成分为细颗粒、SO2和NxOy小重金属离子及芳香烃等,对环境危害极大,对其治理越来越受到重视。下列说法正确的是
A.重金属离子Ag+、Cu2+、K+均可导致蛋白质变性
B.S02和NxOy都属于非金属氧化物,也都是酸性氧化物
C.部分颗粒分散在空气中可能会形成丁达尔现象
D.苯和苯的衍生物都是芳香烃
难度: 中等查看答案及解析
-
下列各组微粒在指定溶液中一定能大量共存的是
A.石蕊变红色的溶液:Na+ .Mg2+ Cl—、SO2-4
B.能溶解氧化铝粉末的溶液中:K+、N0-3、Cl-、NH4+
C.滴加苯酚溶液显紫色的溶液:NH4,K+、Cl-、H2S
D.由水电离出的c ( H+)=10-12mol.L-1的溶液:Na+、K+、.NO3-、C6H5O—
难度: 中等查看答案及解析
-
NA表示阿伙加德罗常数的值。下列判断正确的是
A.常温常压下,17g氨气分子所含质子数为10NA
B.1mol Cl2参加反应,转移电子数一定为2NA.
C.常温常压下,22.4 L C02分子中含有2NA个σ键和2NA个1π键
D.1 L 0. 01 mol.L-1的Na2CO3溶液中含有0.01NA个CO32-
难度: 中等查看答案及解析
-
下列各装置能够达到相应实验目的的是
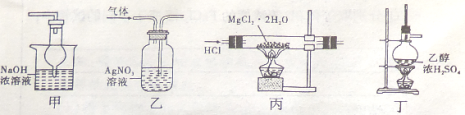
A.用装置甲除去乙酸乙酯中混有的少量乙酸
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙制取无水MgCl2
D.用装置丁制取乙烯
难度: 中等查看答案及解析
-
将物质的量浓度之比为1:2的X(g)与Y(g)在密闭容器中进行反应:X(g)+2Y(g)==32(g)+Q(s) △H>O,下列叙述一定正确的是
A.当容器中X与Y的物质的量浓度之比满足1:2时,反应达到平衡
B.达到平衡后,反应速率3v正(Y) =2v逆(z)
C.达到平衡时,X的转化率为25%,则平衡常数K值为1/16
D.达到平衡后,升高温度,X的体积分数增大
难度: 困难查看答案及解析
-
常温下,向100 mL 0.0l mol.L-lHCl的溶液p 中逐滴加入0. 02 mol.L-lMOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是

A.MOH为一元强碱
B.N点水的电离程度小于K点水的电离程度
C.在K点,c(M+)>c(Cl-)>c(OH-)>c(H+)
D.K点对应的溶液中,有c( MOH) +c( M+)=0.02 mol.L-1
难度: 困难查看答案及解析
-
下列叙述和推论都正确的是叙述
叙述
推论
A
酸性:HCl>H2CO3>H2SiO3
非金属性:Cl>C>Si
B
组成原电池时,通常是还原性较强的物质做负极
镁和铝在氢氧化钠溶液中组成原电池时,镁做负极
C
—OH是亲水基,含有—OH的有机物都易溶于水
常温时,C2H5OH和
 都易溶于水
都易溶于水D
溶解度小的沉淀可转化成溶解度更小的沉淀
向AgCl的悬浊液中滴加KI溶液可以得到AgI沉淀
难度: 中等查看答案及解析