-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol Na被完全氧化生成Na2O2,失去2NA个电子
B.0.5mol锌粒与足量的盐酸反应产生H2为11.2L
C.电解58.5g熔融的氯化钠,能产生23.0g金属钠、22.4L氯气(标准状况)
D.标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA
难度: 中等查看答案及解析
-
有关Na2CO3和NaHCO3的性质,下列叙述中错误的是( )
A. 相同温度下,等浓度的Na2CO3溶液和NaHCO3溶液的碱性比较,前者更强
B. 常温时溶解度:Na2CO3>NaHCO3,且溶于水时均放热
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清的石灰水分别加入Na2CO3和NaHCO3溶液中,都产生白色沉淀
难度: 中等查看答案及解析
-
下列实验对应的现象及结论均正确的是( )
实验现象
结论
A
在酒精灯上加热铝箔,铝熔化,但熔化的铝不滴落
Al的熔点很高
B
取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体
Na2O2没有变质
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体
该溶液中一定含有CO32-
D
用铂丝蘸取某溶液在无色火焰上灼烧,直接观察,火焰颜色呈黄色
原溶液中可能不含K+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
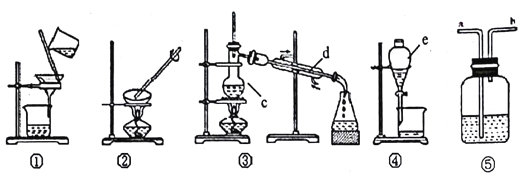
茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.如图是可能用到的实验用品。

有关该实验的说法中正确的是( )
A.第一步需选用仪器①、②和⑨,①的名称叫钳埚
B.第二步用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸
D.第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色
难度: 中等查看答案及解析
-
由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出.将气体通过足量的NaOH溶液,气体体积减少一部分。将上述混合物在空气中加热,有气体放出,下列判断正确的是( )
A.混合物中一定不含有Na2CO3、NaCl
B.混合物中一定不含Na2O2、NaCl
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定有Na2O2、NaHCO3
难度: 中等查看答案及解析
-
下列有关元素及其化合物的说法正确的是( )
A.Al(OH)3 具有两性,所以不能用于中和胃酸
B.FeCl3 既能通过化合反应制得,也能通过金属与酸的置换反应制得
C.Na 在空气中长期放置最终变为 Na2CO3 粉末
D.等质量NaHCO3和Na2CO3分别与足量盐酸反应,生成的CO2在同温同压下体积相同
难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O (方程式中H为+1价,O为-2价)下列说法正确的是( )
A.KClO3在反应中失电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1 molKClO3参加反应有2mol电子转移
难度: 简单查看答案及解析
-
钠与水反应时产生的各种现象如下: ①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色.
其中对现象描述正确的是( )
A.①②③④⑤ B.全部 C.①②③⑤⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
在碱性溶液中,能大量共存的离子组是( )
A. K+、HCO3-、K+、SO42- B. Ba2+、NO3-、Cl-、Na+
C. Na+、Cu2+、SO42-、Cl- D. Ca2+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
常温下,将10g碳酸钙投入0.1L水中(水的密度按1g/mL计算,忽略体积变化),所得溶液的浓度是
A.物质的量浓度大于1mol/L
B.质量分数为9.1%
C.物质的量浓度为1mol/L
D.质量分数小于9.1%
难度: 中等查看答案及解析
-
下列各项操作中,错误的是
A.通过蒸馏酒精水溶液得到95%乙醇,再与生石灰混合,蒸馏可制得无水乙醇
B.进行分液时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出
C.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
D.为保证分液漏斗内的液体顺利流出,需将分液漏斗颈上的玻璃塞打开
难度: 中等查看答案及解析
-
我国近代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积又成丹砂”。这句话所涉及的反应有:①HgS+O2 =Hg+SO2 ②Hg+S=HgS。下列有关说法正确的是
A. 反应①、②中有一个是氧化还原反应
B. 反应①中Hg、O两种元素被还原
C. 反应①中每生成l mol SO2共转移4mole-
D. 反应②中Hg 为氧化剂、S 是还原剂
难度: 中等查看答案及解析
-
氧化还原反应实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是
A.在上述反应中,电子从氧化剂转移到还原剂
B.物质甲可能是KMnO4
C.反应中若产生3.0g气体,则转移电子数约为0.3×6.02×1023
D.氧化过程的反应式一定为Cu2O-2e-+2H+=2Cu2++H2O
难度: 中等查看答案及解析
-
实验室常用热的NaOH溶液洗去试管壁上的硫黄,其反应为6NaOH+3S
2Na2S+Na2SO3+3H2O。在此反应中硫表现的性质是 ( )
A. 氧化性 B. 还原性
C. 既无氧化性又无还原性 D. 既有氧化性又有还原性
难度: 中等查看答案及解析
-
下列化学反应属于区域3 的是
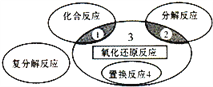
A.Br2+2KI
I2+2KBr B.Cl2+H2O
HCl+HClO
C.2Fe(OH)3
Fe2O3 + 3H2O D.H2O+CaO
Ca(OH)2
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.从1 L 1 mol/L的氯化钠溶液中取出10 ml,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.10 g 98%硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
D.0.5 L 2 mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023
难度: 中等查看答案及解析