-
下列说法错误的是
A.港珠澳大桥用到的铝合金材料,具有强度大、密度小、耐腐蚀等性能
B.第五形态的碳单质“碳纳米泡沫”,与石墨烯互为同素异形体
C.唐代著名诗人杜牧在《泊秦淮》中写道“烟笼寒水月笼沙,夜泊秦淮近酒家”,文中的“烟”能产生丁达尔效应
D.我国西周时发明的“酒曲”酿酒工艺,是利用了催化剂使平衡正向移动的原理
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2. 24 L Cl2溶于水充分反应,转移的电子数为0.1NA
B.25℃时,pH =13的Ba(OH)2溶液中,OH-数目为0. 2NA
C.5.4 gAl分别与浓度均为2 mol.L-1的NaOH溶液和盐酸各100 mL反应,生成H2的分子数均为0.3.NA
D.31 g白磷(P4)分子中含有P-P键数目为1.5NA
难度: 中等查看答案及解析
-
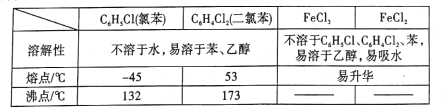
2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据元素性质、相对原子质量等进行排列,预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是

A.乙元素位于现行元素周期表第四周期第ⅥA族 B.原子半径:甲>乙> Si
C.乙的简单气态氢化物的稳定性弱于CH4 D.推测乙的单质可以用作半导体材料
难度: 中等查看答案及解析
-
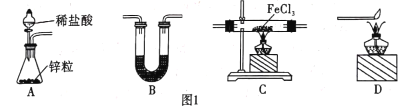
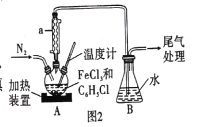
用下列实验方案能达到实验目的的是
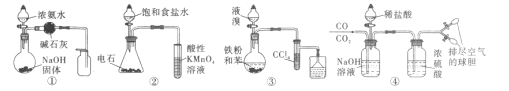
A.用图①的装置制取并收集干燥的NH3 B.用图②的装置验证乙炔的还原性
C.用图③的装置制取溴苯 D.用图④的装置分离CO和CO2
难度: 简单查看答案及解析
-
碳酸亚乙酯是一种重要的添加剂,其结构简式为
。用环氧乙烷合成碳酸亚乙酯的反应为:
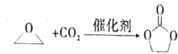 下列说法错误的是
下列说法错误的是A.碳酸亚乙酯中的所有原子处于同一平面内 B.碳酸亚乙酯的二氯代物只有两种
C.上述反应属于加成反应 D.1 mol碳酸亚乙酯最多可消耗2 mol NaOH
难度: 中等查看答案及解析
-
Mg-LiFePO4电池的电池反应为
,其装置示意图如下:(锂离子导体膜只允许Li+通过)。下列说法正确的是
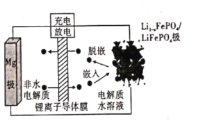
A.放电时,Li+被还原
B.放电时,电路中每流过2 mol电子,有1 mol Mg2+迁移至正极区
C.充电时,阳极上发生的电极反应为:
D.充电时,导线上通过1 mol电子,左室溶液质量减轻12 g
难度: 中等查看答案及解析
-
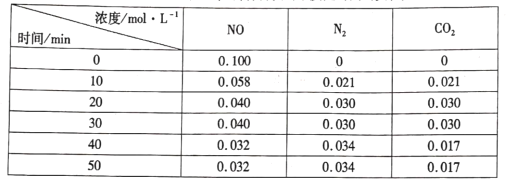
我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )
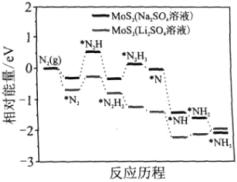
A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
难度: 中等查看答案及解析
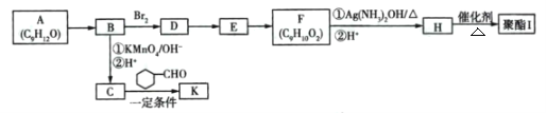
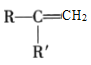
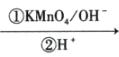
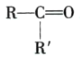 +CO2
+CO2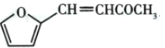 是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[ (CH3)3COH]和糠醛
是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[ (CH3)3COH]和糠醛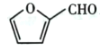 为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________
为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________