-
某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉,反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生下列说法正确的是( )
A. 滤液中一定含有Zn2+和Fe2+,一定没有Ag+
B. 滤液中一定含有Zn2+,一定没有Fe2+和Ag+
C. 滤渣中一定含有银,可能含有锌和铁
D. 滤渣中一定含有银和铁,可能含有锌
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 溶质都是固体 B. 乳化能增强乳浊液的稳定性
C. 均一、稳定的液体都是溶液 D. 搅拌可增大物质的溶解度
难度: 中等查看答案及解析
-
下列变化属于化学变化的是( )
A.
 铁矿石炼铁 B.
铁矿石炼铁 B. 比较合金和纯金属的硬度
比较合金和纯金属的硬度C.
 用氯化钠配制生理食盐水 D.
用氯化钠配制生理食盐水 D. 用洗涤剂洗碗
用洗涤剂洗碗难度: 简单查看答案及解析
-
从化学的角度对下列诗句、成语等进行解释,其中不正确的是( )
A.“遥知不是雪,为有暗香来”﹣﹣分子在不停地运动
B.“点石成金”﹣﹣化学反应改变了元素种类
C.“真金不怕火炼”﹣﹣金(Au)的化学性质不活泼
D.“釜底抽薪”﹣﹣破坏了燃烧的条件
难度: 中等查看答案及解析
-
下列有关实验现象或事实叙述错误的是( )
A.切完西瓜的菜刀洗净擦干放在通风干燥处可以防止生锈
B.神奇的“拉热食品”包装中放置了生石灰
C.用汽油乳化衣服上的油渍,酒精溶解衣服上的碘渍
D.实验室保存的澄清石灰水由于夏天气温高而变浑浊
难度: 简单查看答案及解析
-
“分类”是学习化学的重要方法之一,下列分类正确的是( )
选项
混合物
单质
氧化物
合金
A
乙醇汽油
石墨
CaO
生铁
B
冰水
红磷
干冰
黄铜
C
铁锈
钢
Fe2O3
焊锡
D
碘酒
水
CH4O
金刚石
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于金属材料的说法中正确的是( )
A.铝制品表面应常用钢刷擦洗 B.钢因为比生铁的含碳量高,所以应用范围广
C.焊锡(锡铅合金)的熔点低,常用来焊接金属 D.可用铁桶盛装硫酸铜溶液配制农药波尔多液
难度: 简单查看答案及解析
-
常见金属 X 与硝酸银溶液反应的化学方程式为 X+3AgNO3═3Ag+X(NO3)3,有关该反应说法错误的是( )
A.该反应是置换反应 B.溶液会变成浅绿色
C.金属活动性 X>Ag D.X 表面有银白色固体析出
难度: 中等查看答案及解析
-
小乐同学欲使一不饱和硝酸钾溶液变成饱和溶液但不改变其浓度,正确的方法是( )
A.加热蒸发溶剂后再降至原温度 B.加入一定量的硝酸钾
C.降温后使其析出部分晶体 D.降温至溶液刚好达到饱和
难度: 中等查看答案及解析
-
如下图所示实验,进行中的现象或实验原理正确的是( )
A.
白磷始终未燃烧 B.
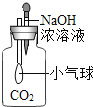 气球变瘪
气球变瘪C.
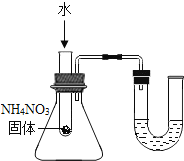 管内液面左高右低 D.
管内液面左高右低 D.验证三种金属活动性强弱
难度: 中等查看答案及解析
-
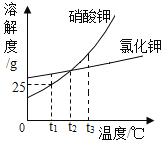
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )

A. t1℃时,甲、乙两种溶液中溶质的质量相等
B. t1℃时,100g甲物质的饱和溶液中溶质的质量是20g
C. 要将甲溶液的状态由a点转化为b点,可以加适量溶剂
D. 分别将t2℃时两种物质的饱和溶液降温至t1℃,均有晶体析出
难度: 困难查看答案及解析
-
小铭将铝丝与一定量稀盐酸混合在一密闭容器内反应,利用压强和温度传感器测出了反应过程中压强和温度随时间变化的关形(如图所示)下列有关说法错误的是( )
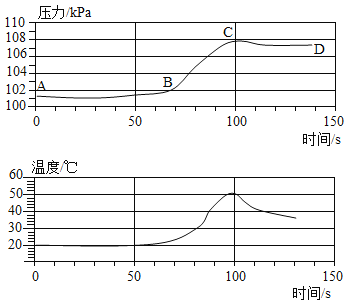
A. 铝和稀盐酸之间的反应是放热反应
B. 由图象可推测出氧化铝能与盐酸反应
C. D点表示铝和稀盐酸恰好完全反应
D. CD气压降低是由于反应结束后温度降低引起的
难度: 中等查看答案及解析
-
下 列 实 验 方 案 不 合 理 的 是( )
选项
实验目的
所用试剂或方法
A
鉴别 NaOH 固体和 NaCl 固体
分别加水溶解
B
鉴别 CuSO4 溶液和 FeSO4 溶液
观察颜色
C
验证锌、铁、银的金属活动性
分别加入稀硫酸
D
除去石灰石中混有的铁粉
加入盐酸、过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下表中,有关量的变化图象与其对应叙述相符的是( )
A.
一定量的饱和石灰水中加入氧化钙
B.
向一定质量的二氧化锰中加入过氧化氢溶液
C.
向一定质量 AgNO3 和 Cu(NO3)2 的混合溶液中加入 Zn 粉
D.
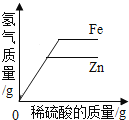 常温下,相同质量的锌和铁与等质量的溶质质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁与等质量的溶质质量分数相同的稀硫酸反应难度: 困难查看答案及解析