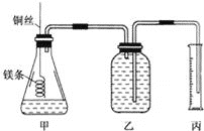
-
某工厂排放的工业废水中可能含有K+、H+、Mg2+、SO42-、Cl-、NO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A. H+、K+、NO3- B. K+、NO3-、SO42- C. H+、Mg2+ D. K+、Mg2+、SO42-、Cl-
难度: 简单查看答案及解析
-
下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
A.Ba(NO3)2 +H2SO4=BaSO4↓+2HNO3 B.BaCl2+Na2SO4=BaSO4↓+2NaCl
C.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑ D.BaCl2+H2SO4=BaSO4↓+2HCl
难度: 简单查看答案及解析
-
下列中草药煎制步骤中,属于过滤操作的是( )
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存
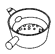
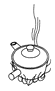
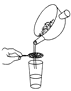
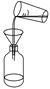
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列事实与胶体知识有关的是
①晨雾中看见叶缝透过光束的通路
②用明矾净水
③静电除尘
④在饱和氯化铁溶液中逐滴加入氢氧化钠溶液,产生红褐色沉淀
⑤一支钢笔使用不同牌号的蓝黑墨水易出现堵塞
⑥血液透析
⑦用可见光鉴别红褐色的氢氧化铁胶体和溴水( )
A.①②⑤⑥⑦ B.①③④⑤⑥ C.①②③⑤⑥⑦ D.全部都有关
难度: 中等查看答案及解析
-
按溶液、浊液、胶体的顺序排列正确的是()
A.雪碧、牛奶、豆浆 B.白糖水、泥水、血液
C.碘酒、珍珠奶茶、茶叶水 D.果冻、澄清石灰水、石灰浆
难度: 中等查看答案及解析
-
对下列物质的分类正确的是( )
A.盐酸属于纯净物 B.SiO2、烧碱、明矾分别为酸性氧化物、碱、盐
C.Cu、NaCl、HCl、氯水均为电解质 D.CaO、Na2O、Na2O2均属于碱性氧化物
难度: 简单查看答案及解析
-
下列我国古代的技术应用中,不涉及氧化还原反应的是
A. 煅烧贝壳
 B. 粮食酿醋
B. 粮食酿醋
C. 古法炼铁
 D. 火药爆炸
D. 火药爆炸
难度: 简单查看答案及解析
-
与100mL 0.1mol/L硫酸钾溶液里钾离子物质的量浓度相同的是( )
A.100mL 0.1mol/L 氯化钾溶液 B.100mL 0.1mol/L 硝酸钾溶液
C.200mL 0.1mol/L 硫酸钾溶液 D.50mL 0.2mol/L 碳酸钾溶液
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.24g镁在足量空气中充分燃烧时转移电子数大于2NA
B.将100mL0.1mol/L的FeCl3溶液滴入沸水中,可制得Fe(OH)3胶粒0.01 NA
C.标准状况下,1.12L CCl4中含有的原子数目为0.25NA
D.3mol单质铁完全转化为Fe3O4,失去8NA电子
难度: 简单查看答案及解析
-
amol H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.
mol-1 B.
mol-1 C.
mol-1 D.
mol-1
难度: 中等查看答案及解析
-
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以左右自由滑动的隔板(其质量忽略不计).其中能表示相同温度时,等质量的氢气与氦气的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
等体积的两容器内,一个盛CH4,另一个盛NH3,若容器内温度、压强相同,则两容器内所盛气体比较,结论一定不正确的是( )
A. 分子个数比为1∶1 B. 原子个数比为5∶4
C. 质量比为17∶16 D. 氢原子个数比为4∶3
难度: 简单查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关.下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失去电子多的还原剂还原性强
D.化学反应中,某元素由化合态变为游离态,此元素可能被氧化
难度: 简单查看答案及解析
-
若24g SO32- 恰好与50mL 2mol/L的R2O72-溶液发生氧化还原反应,其中SO32-→SO42-,则R元素在还原产物中的化合价是
A. +1 B. +2 C. +3 D. +4
难度: 中等查看答案及解析
-
根据反应①2FeCl3+2KI═2FeCl2+2KCl+I2,②2FeCl2+Cl2 = 2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是( )
A. Fe3+>Cl2>I2 B. Cl2>I2>Fe3+ C. Cl2>Fe3+>I2 D. I2>Cl2>Fe3+
难度: 中等查看答案及解析