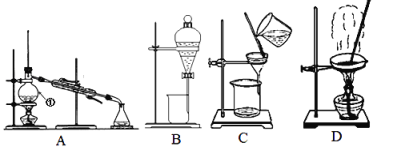
-
对下列实验的评价,正确的是( )
A. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
B. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
C. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
D. 验证烧碱溶液中是否含有Cl﹣,先加稍过量的稀硝酸除去OH﹣,再加入AgNO3溶液,如有白色沉淀,则证明有Cl﹣
难度: 中等查看答案及解析
-
下列叙述正确的是
A.1 molH2O的质量为18g/mol
B.含有3.01×1023个氧原子的SO2分子的质量约为16g
C.CH4的摩尔质量为16g
D.标准状况下,1mol任何物质体积均为22.4L
难度: 简单查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A
由海水(含NaCl)获得蒸馏水
蒸馏
水的沸点与NaCl的沸点不同
B
分离汽油和水
分液
汽油和水的密度不同
C
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D
分离溶于水的碘
乙醇萃取
碘在乙醇中的溶解度较大
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
对危险化学品要在包装标签上印有警示性标志。氢氧化钠应选用的标志是( )




A
B
C
D
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
化学实验设计和操作中必须十分重视安全问题和环保问题.下列实验方法或实验操作不正确的是( )
①在制取氧气中排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
②进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
③水和碘的四氯化碳溶液分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
④进行蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
⑤酒精着火时可用湿抹布或沙子扑灭
⑥用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
A. ①⑥ B. ②③④ C. ②④⑤ D. ③④⑤
难度: 中等查看答案及解析
-
下列萃取与分液结合进行的操作(用CCl4作萃取剂,从碘水中萃取碘)中错误的是( )
A.饱和碘水和CCl4加入分液漏斗中后,塞上口部的塞子,用一手压住分液漏斗上口部,一手握住活塞部分,把分液漏斗倒转过来振荡
B.当分离出下层液体后继续打开活塞,另用容器承接并保存上层液体
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(然后放出下层液体)
难度: 简单查看答案及解析
-
下列物质:①汽油、②四氯化碳、③酒精,可用作萃取碘水中碘的萃取剂是( )
A.①③ B.②③ C.①② D.①②③
难度: 简单查看答案及解析
-
下列实验操作中,正确的是( )

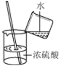
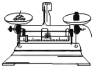
A滴加液体
B过滤
C稀释浓硫酸
D称量固体
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列实验设计方案中,可行的是( )
A.用加入适量NaCl溶液的方法除去Cu(NO3)2溶液中的AgNO3杂质
B.用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体
C.向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42-
D.先后添加石蕊试液、BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开
难度: 简单查看答案及解析
-
两份体积相同的某植物营养液,其配方分别如下:
KCl
K2SO4
ZnSO4
①
0.3 mol·L−1
0.2 mol·L−1
0.1 mol·L−1
②
0.1 mol·L−1
0.3 mol·L−1
—
下列对这两份营养液成分的分析中正确的是
A.K+的物质的量相同 B.Cl−的物质的量相同
C.完全相同 D.
的物质的量不同
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 6.02×1023就是阿伏加德罗常数
B. 0.012kg12C含有的碳原子数就是阿伏加德罗常数的值
C. 某物质含有阿伏加德罗常数个粒子,则其物质的量是1mol
D. 1 molNH3所含原子数约是2.408×1024
难度: 中等查看答案及解析
-
同温同压下,相同体积的O2和O3具有相同的
A. 密度 B. 质量 C. 分子数 D. 原子数
难度: 简单查看答案及解析
-
以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为35.5b/a
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.l mol硫酸钾中阴离子所带电荷数为NA
B.乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有4NA个氢原子
C.22.4L氯气和足量氢气反应转移的电子数为2NA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.2NA个Cl-
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol OH-所含的质子数和电子数都为10NA
B.NA个微粒就是6.02×1023个微粒
C.0.1 mol硫酸中含有的原子总数为0.7NA
D.1 mol CO所含电子数是28NA
难度: 简单查看答案及解析
-
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,N4分子的结构如图所示,下列说法正确的是( )
A.N4属于一种新型的化合物
B.N4与N2的摩尔质量相等
C.等质量的N4与N2所含的原子个数比为1∶1
D.等质量的N4与N2所含的原子个数比为2∶1
难度: 中等查看答案及解析
-
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+浓度为0.4 mol/L,SO42-的浓度为0.7 mol/L,则该溶液中K+的浓度为( )
A.0.1 mol/L B.0.15 mol/L C.0.2 mol/L D.0.25 mol/L
难度: 简单查看答案及解析
-
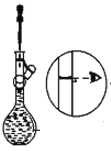
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3﹣的物质的量浓度为
A. 5a/b mol/L B. 10a/b mol/L
C. b/5a mol/L D. a/b mol/L
难度: 中等查看答案及解析
-
V mL Al2(SO4)3溶液中含有Al3+a g,取1/2V mL溶液稀释到2VmL,则稀释后溶液中SO
的物质的量浓度是( )
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 中等查看答案及解析