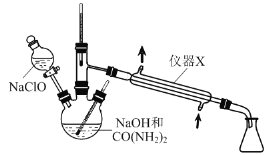
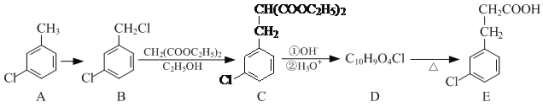
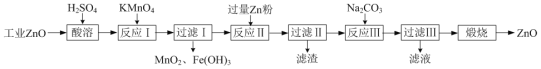
-
水是生命之源,下列关于水的说法正确的是
A.水是非电解质
B.pH=6.8的纯水呈中性
C.降低温度,水的Kw增大
D.电解水制氢气和氧气时可向其中加入盐酸
难度: 简单查看答案及解析
-
下列有关化学用语表示中正确的是
A.电子式:Na:
:Na
B.中子数为22的钙原子:4222Ca
C.NaHSO3水解的离子方程式:HSO3-+H2O
H2SO3+OH-
D.H2CO3的电离方程式:H2CO3=H++HCO3-
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1的(NH4)2SO4溶液中:Na+、Cu2+、Cl-、OH-
B.
=10-12的溶液中:Na+、NO3-、AlO2-、CO32-
C.水电离的c(H+) =1×10-13mol·L-1溶液中:Na+、K+、NO3-、HCO3-
D.0.1 mol·L-1的FeCl3溶液中:K+、Mg2+、SO42-、SCN-
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.向AlCl3溶液中滴加足量氨水:Al3++3NH3·H2O
Al(OH)3↓+3NH4+
B.向碳酸氢钠溶液滴加澄清石灰水:HCO3-+OH-=H2O+CO32-
C.向大理石上滴加醋酸:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
D.用稀硝酸洗涤试管内壁银镜:Ag+2H++NO3-=Ag++NO2↑+H2O
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
A.Al2O3
AlCl3(aq)
无水AlCl3 B.Fe
Fe2O3
Fe(OH)3
C.NH4Cl
NH3
NO D.稀盐酸
Cl2
Ca(ClO)2
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的周期表前20号元素中的四种元素,且分别位于第二、三、四周期。X与Z位于同一主族,Y是地壳中含量最高的金属元素,Z的单质可用于制造半导体芯片,W的原子序数等于X和Y原子序数之和。下列说法正确的是
A.原子半径:r(W)>r(Y)>r(Z)>r(X)
B.简单气态氢化物的热稳定性:Z>X
C.最高价氧化物对应水化物的碱性:Y>W
D.工业上可以用电解W的氯化物的水溶液的方法来制取W的单质
难度: 中等查看答案及解析
-
用0.1000 mol·L-1的HCl标准溶液滴定20.00mL未知浓度的NaOH溶液,下列说法正确的是
A.可以用如图所示的装置及操作进行滴定
B.指示剂可以使用紫色石蕊
C.滴加盐酸的速度应保持匀速,且需不断摇荡锥形瓶
D.若滴加盐酸的滴定管滴定前有气泡,滴定终了无气泡,则所测NaOH溶液浓度偏大
难度: 简单查看答案及解析
-
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn−NiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O
ZnO+2Ni(OH)2。下列说法正确的是
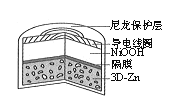
A.放电时负极附近的pH升高
B.放电过程中OH-通过隔膜从负极区移向正极区
C.充电时3D−Zn电极应与外接直流电源的正极相连
D.充电时阳极反应为:Ni(OH)2+OH--e-=NiOOH+H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.钢铁浸泡于食盐水中发生电化学腐蚀时的正极反应为:2H2O+2e-=H2↑+2OH-
B.增大气体压强或使用催化剂能能提高活化分子的百分数,从而加快反应速率
C.反应2CO(g)=2C(s)+O2(g) ΔS<0在任何条件下都不能自发进行
D.工业上合成氨反应N2(g)+3H2(g)
2NH3(g) ΔH<0采用高温是为了提高N2的平衡转化率
难度: 简单查看答案及解析
-
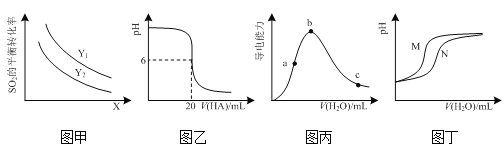
下列说法正确的是
A.常温下,向0.1 mol·L1 CH3COONa中加入少量水,溶液中
比值减小
B.用0.1 mol·L1 NaOH溶液分别中和等体积等pH的盐酸和醋酸,盐酸消耗NaOH溶液的体积大
C.常温下,pH=10的氨水中,由水电离出的OH-浓度为1×10-4mol·L1
D.常温下,向10 mL pH=2的盐酸中分别加入V1 mL的水和V2 mL pH=12的NaOH溶液,所得溶液的pH均为3,忽略混合时溶液体积的变化,则V1∶V2=11∶1
难度: 中等查看答案及解析
-
有机物X的结构如图所示,下列说法正确的是
A.能使酸性高锰酸钾溶液褪色
B.X分子中含有2个手性碳原子
C.能与FeCl3溶液发生显色反应
D.1 mol X最多能与5 mol H2发生加成反应
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
A.向0.1 mol·L1 KMnO4溶液中滴加双氧水,溶液紫红色褪去,说明H2O2具有漂白性
B.向0.1 mol·L1 NaHCO3中滴加HF溶液,有气泡产生,说明HF是强酸
C.向0.1 mol·L1 CH3COOH中加入少量CH3COONa(s),溶液酸性减弱,说明CH3COOH是弱酸
D.常温下,测定等浓度的Na2CO3和C6H5ONa溶液的pH,前者pH比后者的大,说明酸性:C6H5OH>H2CO3
难度: 中等查看答案及解析