-
化学在生产和生活中有着重要的应用,下列说法正确的是( )
A.“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物有关
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂,须限量使用
难度: 中等查看答案及解析
-
下列说法中,错误的是( )
①合金比纯金属具有较好的性能,硬度都比成分金属大,熔点比成分金属的低
②常用电解法冶炼钠、镁、铝等活泼金属
③将钢闸门与电源正极相连,可防止其在海水中被腐蚀
④Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
⑤Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同
⑥Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3
⑦制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法
A.①②⑥ B.④⑤ C.③④⑦ D.③④⑤⑦
难度: 中等查看答案及解析
-
下列有关物质的性质和应用均正确的是( )
①氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂,84消毒液的有效成分是NaClO
②浓硫酸具有强氧化性,不能干燥SO2等还原性的气体;过氧化钠具有强氧化性,可用作潜水艇中氧气的来源
③硅在元素周期表中处于金属与非金属的交界位置,是重要的半导体材料,在自然界中可以以游离态和化合态的形式存在
④浓氨水可检验氯气管道是否漏气
⑤玻璃容器可长期盛放各种酸
⑥Na2S可除去污水中的Cu2+
⑦碘酒是指单质碘的乙醇溶液
⑧明矾作净水剂,液氨用作制冷剂,生石灰作干燥剂
A.①④⑦⑧ B.④⑥⑦⑧ C.②⑦⑧ D.②③⑦⑧
难度: 中等查看答案及解析
-
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
组别
甲
乙
丙
A
Al(OH)3
HCl
NaOH
B
NH3
O2
HNO3
C
SO2
Ca(OH)2
NaHCO3
D
O2
N2
H2
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理不同
B.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
C.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
D.用AgNO3溶液可以鉴别KCl和KI
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.某气体能使澄清石灰水变浑浊,则该气体是CO2
B.向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl-
C.向某溶液中加入Ba(NO3)2溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中有SO
D.向某溶液中加入NaOH并加热,产生可使湿润的红色石蕊试纸变蓝的气体,则原溶液中有NH
难度: 中等查看答案及解析
-
关于如下图进行的实验的说法,正确的是( )
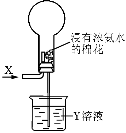
A.若X为HCl,则烧瓶内可产生白雾
B.选择适当的X和Y溶液可产生有色喷泉
C.若烧瓶内产生喷泉,则Y溶液一定呈酸性
D.若通入气体为Cl2,则烧瓶内一定无喷泉产生
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.Cu溶于稀HNO3:Cu+2H++NO===Cu2++NO2↑+H2O
B.NaHCO3溶液中加入稀盐酸:CO+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO+4NH+2H2O
D.向NaAlO2溶液中通入过量CO2制Al(OH)3: CO2+AlO+2H2O===Al(OH)3↓+HCO
难度: 中等查看答案及解析
-
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH、Cl-、S2-
B.0.1 mol·L-1FeCl3溶液中大量存在Fe2+、NH、SCN-、SO
C.0.1 mol·L-1NH4HCO3溶液中:K+、Na+、NO、Cl-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.O2和O3共32 g混合物中氧原子的个数为2NA
B.78 g苯含有C===C 键的数目为3NA
C.1 mol Na2O2固体中含离子总数为4NA
D.足量Fe与1 mol 氯气反应时转移的电子数为3NA
难度: 中等查看答案及解析
-
下列反应中,反应后固体物质增重的是( )
A.氨气通过灼热的CuO粉末 B. 将锌粒投入Cu(NO3)2溶液
C.铝与Fe2O3发生铝热反应 D.水蒸气通过Na2O2粉末
难度: 中等查看答案及解析
-
下列除杂方案正确的是( )
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO2(g)
SO2(g)
饱和NaHSO4溶液、浓H2SO4
洗气
B
NH4Cl(aq)
Fe3+(aq)
NaOH溶液
过滤
C
Cl2(g)
HCl(g)
饱和NaHCO3溶液、浓H2SO4
洗气
D
Na2CO3(s)
NaHCO3(s)
—
灼烧
难度: 中等查看答案及解析
-
用自来水配制下列溶液,不会变质的是( )
A.AgNO3 B.Na2CO3 C.NaCl D.KI
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
选项化合物
A
B
C
D
Y
CO2
Fe2O3
SiO2
FeCl3
W
MgO
Al2O3
CO
CuCl2
难度: 中等查看答案及解析
-
在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中的固体剩余物是( )
A.Na2CO3和Na2O2 B.Na2CO3和NaOH C.NaOH和Na2O2 D.NaOH、Na2O2和Na2CO3
难度: 中等查看答案及解析
-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
难度: 中等查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是( )
A.Fe(OH)2 B.Fe2O3 C. FeO D.Fe3O4
难度: 中等查看答案及解析
-
下列有关实验现象和解释或结论都正确的选项是( )
选项
实验操作
现象
解释或结论
A
把SO2通入紫色石蕊试液中
紫色褪去
SO2具有漂白性
B
把浓硫酸滴到pH试纸上
试纸变红
浓硫酸具有酸性
C
将充满NO2的密闭玻璃球浸泡在热水中
红棕色变浅
反应2NO2
N2O4的ΔH<0
D
向AgCl沉淀中滴加KI溶液
白色沉淀
变为黄色
溶度积:AgI比
AgCl更小
难度: 中等查看答案及解析
-
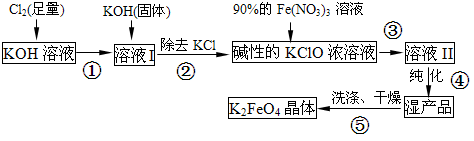
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)。下列有关说法错误的是( )
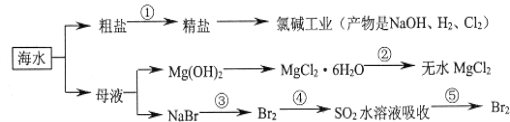
A.从能量转换的角度来看,氯碱工业中的电解饱和食盐水是一个将电能转化为化学能的过程
B.过程②中结晶出的MgCl2·6H2O要在HCl的氛围中加热脱水制得无水MgCl2
C.在过程③、⑤中溴元素均被氧化
D.除去粗盐中的SO
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
难度: 中等查看答案及解析
-
在100mL混合液中,HNO3和H2SO4物质的量浓度分别是0.4mol/L和0.1mol/L,向该混合液中加入1.92gCu粉,加热充分反应后,所得溶液中Cu2+的物质的量浓度是( )
A.0.15 mol/L B. 0.45 mol/L C.0.35 mol/L D.0.225 mol/L
难度: 中等查看答案及解析
-
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
A.在此反应中硝酸只体现强氧化性
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
难度: 中等查看答案及解析
-
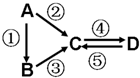
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如下图所示。

下列分析错误的是( )
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
难度: 中等查看答案及解析