-
碳纳米管、石墨烯、C60等新型碳材料具有广阔的应用前景。下列说法正确的是

A. 碳纳米管属于胶体
B. 石墨烯属于有机化合物
C. C60与金刚石互为同素异形体
D. 均具有相同的熔点
难度: 中等查看答案及解析
-
三苯甲烷常用做有机合成中间体,结构如图所示。下列有关该化合物的说法正确的是
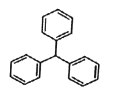
A. 与苯互为同系物
B. 一氯代物有3种
C. 与9mol H2反应生成1molCl9H40
D. 所有碳原子不可能在同一平面
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,2. 24L Hl3CHO含中子数为1.5NA
B. 7. 1g Cl2通入5L水中反应转移的电子数为0.1NA
C. 含S2-、HS-共1mol的Na2S溶液中含Na+数目为2NA
D. 10 g质量分数为17%的H2O2水溶液中含氧原子数目为0.1NA
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期主族元素。X、Z、W形成的一种离子是检验Fe3+的常用试剂,X、Y形成的化合物YX3,常用作汽车安全气囊的气体发生剂,W的单质在加热条件下可与X、Z的最高价含氧酸反应。下列叙述正确的是
A. 原子半径:Z>Y>W>X
B. YX3属于离子化合物
C. Y、Z形成的化合物中只含有离子键
D. Z的氧化物对应的水化物属于强酸
难度: 中等查看答案及解析
-
根据下列实验操作和现象,所得结论或推论正确的是
选项
现象
结论或推论
A
将镁条投入热的无水乙醇中
镁表面有气泡产生
乙醇具有酸性
B
向饱和NaHCO3溶液中滴加硼酸
无气泡产生
酸性:硼酸>碳酸
C
向Na2SO3溶液中滴加硝酸
有气泡产生
该气态是SO2
D
分别向硫酸和NaOH溶液中滴入3滴乙酸乙酯,水浴 一段时间后
装硫酸的试管有香味,装NaOH的五香味
酯在酸性条件下不水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一种新型锂离子电池的工作原理如图所示,其中a极区含有Li+、I-、I3-等离子的水溶液,电极b是一种固态有机聚合物。下列说法不正确的是
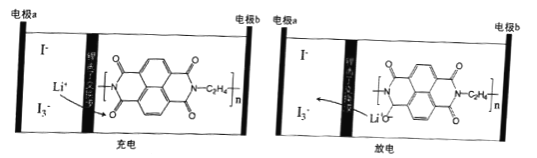
A. 充电时,a极区I3-的浓度增大
B. 充电时,电极b与外接电源的负极连接
C. 放电时,电极a可能发生反应I3-+2e-= 3I-
D. 放电时,外电路中每转移0. 1mol电子,电极b增重0.7g
难度: 中等查看答案及解析
-
常温下,向25mL 0.12mol/LAgNO3溶液中逐滴加入浓度为2%的氨水,先出现沉淀,继续滴加沉淀溶解。该过程中加入氨水的体积V与溶液中lg[c(H+)/c(OH-)]的关系如图所示。已知e点时溶液迅速由浑浊变得澄清,且此时溶液中c(Ag+)与c(NH3)均约为2×10-3 mol/L。下列叙述不正确的是
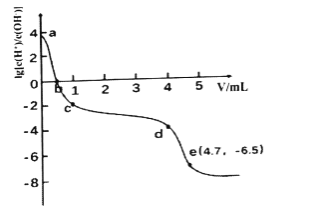
A. a点溶液呈酸性的原因是AgNO3水解
B. b点溶液中:c(Ag+)+c[Ag(NH3)2+]<c(NO3-)
C. cd段加入的氨水主要用于沉淀的生成和溶解
D. 由e点可知,反应Ag++2NH3
[Ag(NH3)2]+平衡常数的数量级为105
难度: 困难查看答案及解析


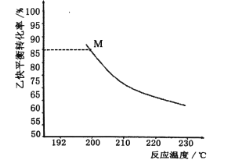
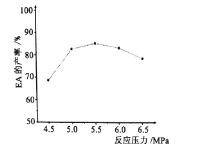
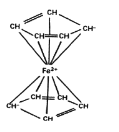
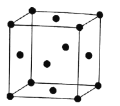
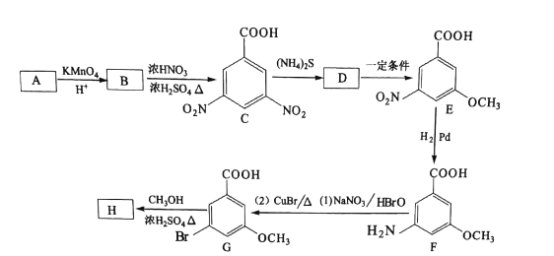
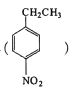 为起始原料制备化合物
为起始原料制备化合物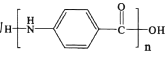 的合成路线(其他试剂任选)。_____
的合成路线(其他试剂任选)。_____