-
《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶……”。文中涉及下列操作方法的是( )
A. 溶解 B. 渗析 C. 蒸馏 D. 分液
难度: 简单查看答案及解析
-
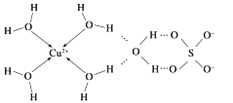
短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是( )
A. 简单离子的半径:Y>Z>X
B. 简单氢化物的沸点:Y>X
C. 最高价氧化物对应水化物的碱性:Z> Y
D. Y、Z的氧化物所含化学键类型相同
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
难度: 中等查看答案及解析
-
三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是
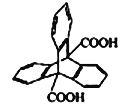
A. 分子式为C22H14O4
B. 能发生加成、取代反应
C. 苯环上的一氯代物有3种
D. 分子中最多可能有20个原子位于同一平面上
难度: 中等查看答案及解析
-
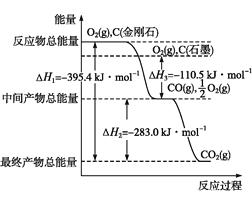
用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )
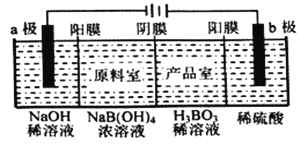
A. 阴极与阳极产生的气体体积比为1:2
B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ
D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
难度: 困难查看答案及解析
-
25℃时,用0.10 mol/L的氨水滴定10.00mL0.05mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中
的关系如图所示。下列说法正确的是( )

A. H2A的电离方程式为H2A
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 植物油的主要成分是高级脂肪酸
B. 异丙苯(
)中碳原子可能处于同一平面上
C. 某些蛋白质可溶于溶剂形成分子胶体,但遇乙醇发生变性
D. 分子式为C4H10O并能与金属钠反应的有机物有5种(不含立体异构)
难度: 中等查看答案及解析
-
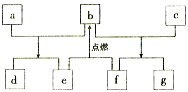
电动公交车替代燃油公交车是节能减排、控制雾霾的重要举措之一,下图所示电池是一种正在开发的车载电池。有关该电池的说法正确的是( )
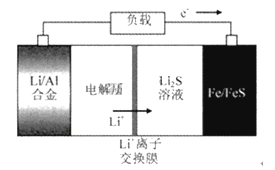
A. 放电时Fe/FeS 极是负极 B. 放电时负极反应式为:Al-3e-=Al3+
C. 充电时阳极反应式为:Fe+S2--2e-=FeS D. 左边电解质可以是LiOH的醇溶液
难度: 中等查看答案及解析