-
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:( )
A. A>B>C>D B. A>C>D>B C. C>A>B>D D. B>D>C>A
难度: 中等查看答案及解析
-
关于原电池的叙述中正确的是( )
A. 原电池是把化学能转变为电能的装置
B. 构成原电池正极和负极的必须是两种不同金属
C. 原电池电解质溶液中阳离子向负极移动
D. 理论上,所有的氧化还原反应都能设计成原电池
难度: 简单查看答案及解析
-
下列关于强、弱电解质的叙述中正确的是( )
A. 强电解质都是离子化合物,弱电解质都是共价化合物
B. 强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C. 强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D. 强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
难度: 简单查看答案及解析
-
在氨水中存在下列电离平衡:NH3·H2O
+OH-,下列情况能引起电离平衡向逆向移动的有( )
① 加NH4Cl固体 ② 加NaOH溶液 ③ 通HCl ④ 加CH3COOH溶液 ⑤ 加AlCl3固体
A. ① ② B. ① ③ ⑤ C. ③ ④ ⑤ D. ① ② ④
难度: 中等查看答案及解析
-
1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为( )
A. C+H2O===CO+H2 ΔH=+131.3 kJ·mol-1
B. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+10.94 kJ·mol-1
C. C(s)+H2O(l)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
D. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
难度: 中等查看答案及解析
-
室温,将0.1 mol·L-1HCl溶液和0.06 mol·L-1的Ba(OH)2溶液等体积混合后,则该溶液的pH是( )
A. 1.7 B. 12.3 C. 12 D. 1
难度: 简单查看答案及解析
-
25 ℃,某pH=2的HCl溶液中,由水电离的c(H+)为( )
A. 1.0×10-12mol·L-1 B. 1.0×10-7mol·L-1 C. 1.0×10-10mol·L-1 D. 1.0×10-2mol·L-1
难度: 简单查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定能大量共存的离子组是
A. Al3+ Na+ NO3- Cl- B. K+ Na+ Cl- NO3-
C. K+ Na+ Cl- HCO3- D. K+ Fe2+ SO42- NO3-
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++ OH-;ΔH > 0 ,下列叙述正确的是
A. 向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C. 向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
下列反应不可用于设计成原电池的是( )
A. CaCO3+2HCl=CaCl2+CO2↑+H2O B. 2CH3OH+3O2=2CO2+4H2O
C. Zn+2HCl=ZnCl2+H2↑ D. 4Al+3O2+6H2O=4Al(OH)3
难度: 简单查看答案及解析
-
在未知溶液中再加入CH3COONa晶体,测得c(Na+)与c(CH3COO-)几乎相等,则原来的溶液可能是
A. HCl溶液 B. NaOH溶液 C. KCl溶液 D. KOH溶液
难度: 中等查看答案及解析
-
某一反应在一定条件下的平衡转化率为25.3%,当使用了催化剂时,其转化率为( )
A. 大于25.3% B. 小于25.3% C. 等于25.3% D. 约等于25.3%
难度: 中等查看答案及解析
-
已知HA为酸性略强于醋酸的一元弱酸,则在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
A.c(Na+)>c(A-)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(A-)+c(OH-)
C.c(Na+)+c(OH-)=c(A-)+c(H+)
D.c(Na+)>c(OH-)>c(A-)>c(H+)
难度: 中等查看答案及解析
-
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
A. 向饱和AgCl水溶液中加入盐酸,Ksp值变大
B. AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C. 温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D. 将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,Ksp(AgI)<Ksp(AgCl),所以S(AgI)<S(AgCl)
难度: 中等查看答案及解析
-
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
A.
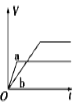 B.
B. 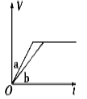 C.
C. 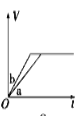 D.
D. 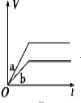
难度: 中等查看答案及解析
-
密闭容器中盛有1 mol PCl5,加热到200℃时发生了反应:PCl5(g)
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
A. M>N B. M<N C. M=N D. 无法确定
难度: 中等查看答案及解析
-
将铝片和镁片用导线连接后插入盛有NaOH溶液的烧杯中组成原电池,下列说法正确的是( )
A. Mg为负极,有Mg(OH)2生成 B. 镁为正极,镁片质量增加
C. 铝为负极,有NaAlO2生成 D. 铝为正极,铝片质量不变
难度: 中等查看答案及解析
-
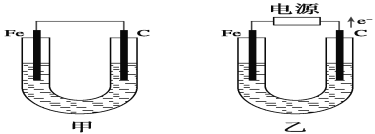
控制适合的条件,将反应
设计成如右图所示的原电池。下列判断不正确的是( )
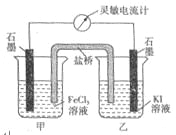
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上
被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入
固体,乙中的石墨电极为负极
难度: 困难查看答案及解析
-
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是
A. 电解过程中阴极没有气体生成
B. 电解过程中转移的电子的物质的量为0.4 mol
C. 原CuSO4溶液的浓度为0.1 mol·L-1
D. 电解过程中阳极收集到的气体体积为1.12 L(标况下)
难度: 中等查看答案及解析
-
一定温度下,水溶液中H+和OH-的浓度变化曲线如下图,下列说法正确的是( )
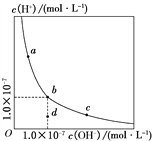
A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为1.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
难度: 中等查看答案及解析