-
中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是
A. 火法炼铜 B. 转轮排字 C. 粮食酿酒 D. 钻木取火
难度: 中等查看答案及解析
-
下列说法正确的是
A.
的一氯代物有2种
B. 脂肪在人体内通过直接的氧化分解过程,释放能量
C.
与
互为同系物
D. 通过石油裂化和裂解可以得到甲烷、乙烯和苯等重要化工基本原料
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A. 2gD2O和H2l8O混合物中所含中子数为NA
B. 1L0.1mol·L-1 NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA
C. 常温常压下,0.5 mol Fe和足量浓硝酸混合,转移电子数为1.5NA
D. 0.1 mol H2和0.1 mol I2 (g)于密闭容器中充分反应,其原子总数为0.2NA
难度: 中等查看答案及解析
-
下列有关实验的选项正确的是
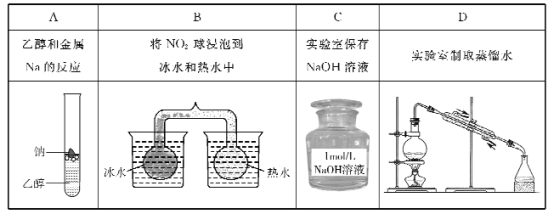
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小,最高正价或最低负价的变化如图所示,下列说法错误的是
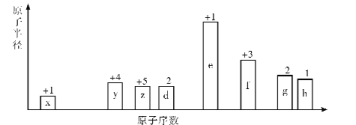
A. 常见离子半径:g>h>d>e
B. 上述元素组成的ZX4f(gd4)2溶液中,离子浓度:c(f3+)>c(zx4+)
C. 由d、e、g三种元素组成的盐溶液和稀硫酸反应可能生成沉淀
D. f的最高价氧化物的水化物可以分别与e和h的最高价氧化物的水化物发生反应
难度: 中等查看答案及解析
-
以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法正确的是
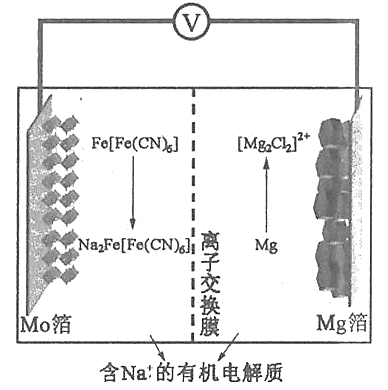
A. 放电时,Mo箔上的电势比Mg箔上的低
B. 充电时,Mo箔接电源的负极
C. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充电时,外电路中通过0.2mol电子时,阴极质量增加3.55g
难度: 困难查看答案及解析
-
对FeC13溶液与KI溶液反应进行探究实验,按选项ABCD顺序依次进行操作,依据现象,所得结论错误的是
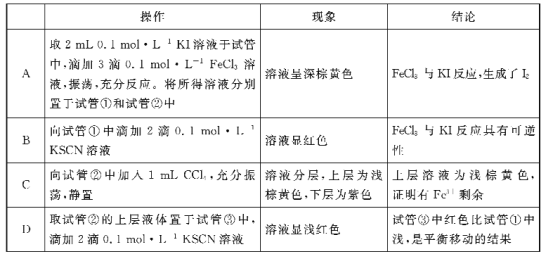
A. A B. B C. C D. D
难度: 中等查看答案及解析
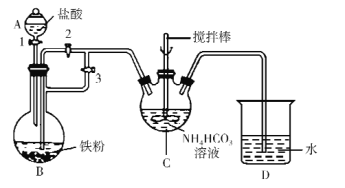
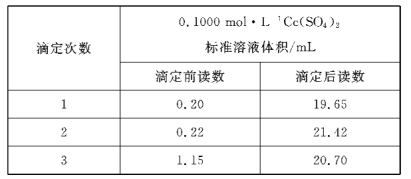
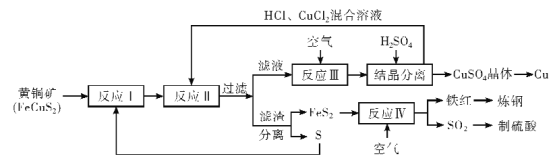
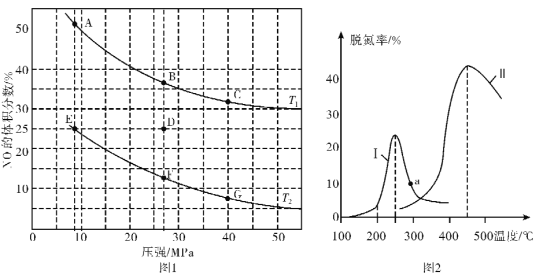
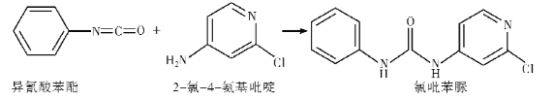
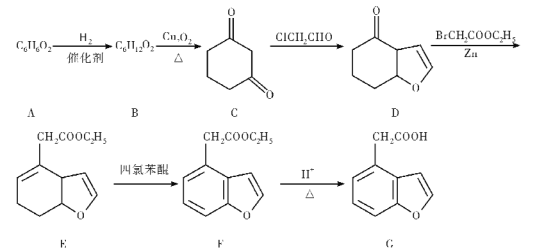
 的合成路线____________。
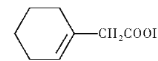
的合成路线____________。