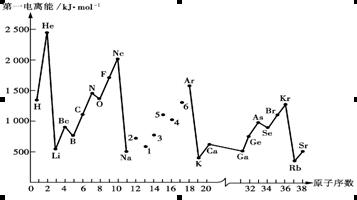
-
电子在一个原子的下列能级的原子轨道中排布时,最后排布的是( )
A.ns B.np
C.(n-1)d D.(n-2)f
难度: 简单查看答案及解析
-
已知某元素的+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中属于( )
A.第3周期ⅤB族 B.第4周期ⅡB族
C.第4周期Ⅷ族 D.第4周期ⅡA族
难度: 简单查看答案及解析
-
对于钠原子的第3层电子的p轨道3px、3py、3pz间的差异,下列几种说法中正确的是( )
A.电子云形状不同 B.原子轨道的对称类型不同
C.电子(基态)的能量不同 D.电子云空间伸展的方向不同
难度: 简单查看答案及解析
-
根据下表所列电离能I/kJ·mol-1的数据,下列判断中错误的是( )
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A. 元素X和Y可能是同周期元素
B.元素X不可能是ⅡA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.元素Y在化学性质上与锡相似
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
难度: 简单查看答案及解析
-
用价电子对互斥理论预测H2S和BF3的空间构型,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.分子的形状BF3与BCl3全等
B.分子的形状CHCl3与CH3Cl全等
C.CCl4与C2H6分子中心原子原子轨道杂化的方式相同
D.BF3与NF3分子中心原子原子轨道杂化的方式相同
难度: 简单查看答案及解析
-
第四周期元素原子中未成对的电子数最多可达 ( )。
A.4个 B.5个 C.6个 D.7个
难度: 简单查看答案及解析
-
有下列两组命题 ,B组命题正确且能用A组命题加以正确解释的是( )。
A.Ⅰ① B.Ⅱ② C.Ⅲ③ D.Ⅳ④
A组
B组
Ⅰ、H—I键键能大于H—Cl键键能
①HI比HCl稳定
Ⅱ、H—I键键能小于H—Cl键键能
②HI沸点比HCl高
Ⅲ、HI分子间作用力大于HCl分子间作用力
③HI沸点比HCl高
Ⅳ、HI分子间作用力大于HCl分子间作用力
④HI沸点比HCl低
难度: 简单查看答案及解析
-
如图是2pz轨道电子云的示意图,请观察图,并判断下列说法中不正确的是( )
A.2pz轨道上的电子在空间出现的概率分布是z轴对称
B.点密集的地方表明电子出现的机会多
C.电子先沿z轴正半轴运动,然后在负半轴运动
D.2pz轨道形状为两个椭圆球

难度: 简单查看答案及解析
-
下列化学用语表达不正确的是
A.Na+的结构示意图:
B.水分子的电子式:
C.二氧化碳的结构式: O=C=O D.碳酸氢钠的电离方程式:NaHCO3= Na+ + HCO3ˉ
难度: 简单查看答案及解析
-
水的三态的熵值的大小关系正确的是
A. S(s)>S(l)>S(g) B. S(l)>S(s)>S(g)
C. S(g)>S(l)>S(s) D. S(g)>S(s)>S(l)
难度: 简单查看答案及解析
-
钢铁在中性条件下发生电化学腐蚀时,正极的电极反应式为
A.2H2O+O2+4e-=4OH- B.2H++2e-=H2↑
C.Fe-2e-=Fe2+v D.Fe-3e-=Fe3+
难度: 简单查看答案及解析
-
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A.NH4+的水解反应离子方程式:NH4+ + H2O
NH3·H2O + H+
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag+ + I- = AgI↓
C.镀铜时,阳极的电极反应式为: Cu2++2e- == Cu
D.某反应⊿H<0,则该反应在任意条件下均可自发进行。
难度: 简单查看答案及解析
-
在相同温度时,100mL0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
A. H+的物质的量 B. 醋酸的电离常数
C. 中和时所需NaOH的量 D. CH3COOH的物质的量
难度: 简单查看答案及解析
-
甲溶液的pH是4,乙溶液的pH是5,则甲溶液与乙溶液的c(OH-)之比为
A.4∶5 B. 1∶10 C.10∶1 D. 1∶2
难度: 简单查看答案及解析
-
常温下,取浓度相同的NaOH和HCI溶液,以体积比3:2相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01 mol/L B. 0.017 mol/L
C.0.05mol/L D.0.50 mol/L
难度: 简单查看答案及解析
-
在容积不变的密闭容器中,一定条件下发生反应:2A(?)
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为非气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
难度: 简单查看答案及解析
-
下列溶液中有关物质的量浓度关系不正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+) == c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)
D.0.1 mol/L的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2—)
难度: 简单查看答案及解析
-
如下图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
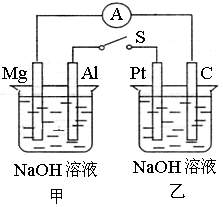
A.电流表指针不发生偏转高
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH不变高
D.Mg、C两极生成的气体可以恰好完全反应
难度: 简单查看答案及解析