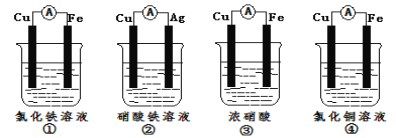
-
CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O = Ca(OH)2+2H2↑,下列有关CaH2的说法正确的是
A. 其中阴、阳离子个数比为2:1
B. 其中既含离子键又含非极性键
C. 其中氢元素的化合价为+1价
D. 与水反应时,CaH2中的氢元素既被氧化也被还原
难度: 简单查看答案及解析
-
一定温度下,10mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
12
V(O2)/mL
0
9.9
17.2
22.4
26.5
29.9
a
下列叙述正确的是(溶液体积变化忽略不计) ( )
A. 12min时,a=33.3
B. 反应到6min时,c(H2O2)=0.30 mol·L-1
C. 反应到6min时,H2O2分解了60%
D. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2 mol·L-1·min-1
难度: 中等查看答案及解析
-
海洋中的单细胞浮游生物能收集阳光并将其转变为食物,在此过程中它们可以从大气中摄取二氧化碳并释放出氧气。下列说法不正确的是
A. 该过程中没有涉及到化学变化
B. 该过程主要是太阳能转化成化学能
C. 如果能揭示其中的奥秘,就能够找到解决温室效应的新方法
D. 弄清此变化过程,将有助于人类更好地利用太阳能,缓解能源危机
难度: 中等查看答案及解析
-
不属于主族元素之间置换反应的是( )
A. 2Al+Fe2O3
Al2O3+2Fe B. 2Na+2H2O=2NaOH+H2↑
C. 2KI+Br2=2KBr+I2 D. 2Mg+CO2=2MgO+C
难度: 中等查看答案及解析
-
关于元素周期表,下列叙述中正确的是( )
A. 周期表中第15列元素的最高价氧化物对应水化物的化学式均为H3RO4
B. 所有主族元素的简单离子所带电荷数与其族序数相等
C. 第Ⅷ族有三个纵行,是元素种类最多的族
D. O22—与S2—具有相同的质子数和电子数
难度: 中等查看答案及解析
-
下列有关卤素的说法错误的是( )
A. 新制氯水显浅黄绿色,但放置一段时间之后颜色会褪去
B. 由HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律
C. 淀粉碘化钾在空气中变蓝,发生了4I—+O2+2H2O=2I2+4OH—
D. HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强
难度: 中等查看答案及解析
-
将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧, 这样处理的目的是:
①使煤充分燃烧, 提高煤的利用率
②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生, 避免污染空气
④减少CO2的产生,避免“温室效应”
A. ①②③ B. ②③④
C. ①③④ D. ①②③④
难度: 简单查看答案及解析
-
一定能使化学反应速率加快的因素( )
①扩大容器容积 ②使用正催化剂 ③增大反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大压强
A. ②③ B. ②③④⑥ C. ②③④⑤ D. ②④
难度: 中等查看答案及解析
-
下列关于元素金属性、非金属性强弱判断不正确的是( )
A. 高温下2C+SiO2
2CO↑+Si,说明非金属性:C>Si
B. 碱性:KOH>Mg(OH)2,说明金属性:K>Mg
C. 氟气与氢气在暗处相遇就会爆炸,氯气与氢气混合在光照或点燃时发生爆炸,说明非金属性:F>Cl
D. 氧化性:Cu2+>Na+,说明金属性:Na>Cu
难度: 中等查看答案及解析
-
R、W、X、Y、Z为同一短周期中原子序数依次递增的元素,下列说法一定正确的是(m、n均为正整数)( )
A. 若R(OH)n为强碱,则W(OH)n+1也为强碱
B. 若HnXOm为强酸,则Y是活泼非金属元素
C. 若Y的最低化合价为-2,则Z的最高正化合价为+6
D. 若X的最高正化合价为+5,则五种元素都是非金属元素
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 氮气的电子式:
B. 重水的化学式:D2O
C. 16O2-和18O2-的结构示意图:
D. N2H4的结构式:
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 金刚石是碳元素的一种核素
B. 126C、146C互为同素异形体
C. H2、D2、T2在相同条件下的密度比为1:2:3
D. 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,其化学性质不同
难度: 中等查看答案及解析
-
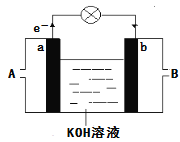
某种碱性氢氧燃料电池的正极反应式为:O2+4e—+2H2O=4OH—。下列有关该电池的叙述正确的是( )
A. 工作时,电解质溶液中的OH-向正极移动 B. 工作一段时间后,电解液中c(OH—)减小
C. 负极上发生的反应为H2 -2e— = 2H+ D. 若电池在工作过程中有0.4mol电子转移,则正极消耗2.24LO2
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是( )
A. 最高正化合价:Z>X
B. X、Y、Z的单质中,Z的熔点最高
C. 若X为非金属元素,则离子半径:Xn->Ym->Zm-
D. 若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A. 两种粒子,若核外电子排布完全相同,则其化学性质一定相同
B. H2O比H2S分子稳定,是因为H2O分子间能形成氢键
C. 含有共价键的化合物一定是共价化合物
D. 两种原子,如果核外电子排布相同,则一定属于同种元素
难度: 中等查看答案及解析
-
已知:4HCl(g)+O2(g)
2C12(g)+2H2O(g) △H =-123 kJ·mol-1。其中相关的化学键键能数据如下:
化学键
H-Cl
O=O
Cl-Cl
H-O
E/ kJ·mol-1
431
497
a
465
其中a值为( )
A. 242 B. 303.5 C. 180.5 D. 365
难度: 简单查看答案及解析
-
下列各组反应(表示物质均为反应物)中,反应刚开始时,放出氢气速率最大的是( )
编号
金属(块状)
酸的浓度及体积
反应温度(℃)
A
0.2mol Mg
10 mL2.5 mol·L-1硫酸
60
B
0.2mol Mg
40 mL3 mol·L-1盐酸
60
C
0.2mol Fe
50 mL5 mol·L-1盐酸
60
D
0.2mol Mg
20 mL2.5 mol·L-1硫酸
50
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生反应:2HI(g)
H2(g)+I2(g),0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是( )
A. 容器中,反应平衡时的压强大于起始时的压强
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间大于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.002mol/(L·s)
难度: 中等查看答案及解析
-
可逆反应2A(g)
2B(g)+C(g)在恒压的密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是( )
A. 容器内气体密度不再改变的状态
B. v(A):v(B):v(C)=2:2:1
C. c(A):c(B):c(C)的值保持不变
D. 混合气体的平均相对分子质量不再改变的状态
难度: 中等查看答案及解析
-
化合物A放入密闭容器中加热,在一定条件下存在如下两个平衡:A(s)
2B(g)+ C(g) ;2C(g)
D(g)+ 3E(g)经测定,平衡时,c(C)=0.01mol/L,c(E)=0.015mol/L,则B的浓度为( )
A. 0.04mol/L B. 0.025mol/L C. 0.03mol/L D. 0.02mol/L
难度: 中等查看答案及解析
-
NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如下图,下列说法正确的是( )
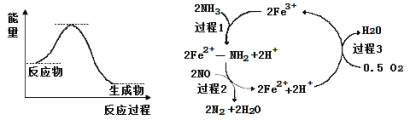
A. 脱硝的总反应为:4NH3(g)+4NO(g)+O2(g)
4N2(g)+6H2O(g)
B. NH3催化还原NO为吸热反应
C. 过程1中NH3断裂非极性键
D. 过程中NO为氧化剂,Fe2+为还原剂
难度: 中等查看答案及解析