-
下列有关物质的性质与用途对应关系正确的是
A. 明矾易溶于水,可用作净水剂 B. HClO显酸性,可用于杀菌消毒
C. SO2具有氧化性,可用于纸浆漂白 D. 铁粉具有还原性,可用作食品抗氧化剂
难度: 简单查看答案及解析
-
2016年世界环境日,我国环保部公布中国主题为“改善环境质量,推动绿色发展”。下列做法与该主题相违背的是( )
A. 推广和鼓励多使用公共交通工具出行
B. 植树造林,绿化环境
C. 利用廉价煤炭,大力发展火力发电
D. 对燃煤进行脱硫,减少空气的污染
难度: 简单查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是
A. H+ Na+ CO32- Cl- B. Ba2+ Na+ Cl- SO42-
C. K+ H+ SO42- OH- D. Ag+ Al3+ NO3- H+
难度: 中等查看答案及解析
-
下列物质转化在一定条件下不能实现的是
A. Al2O3→Al(OH)3→Al B. Cu→CuO→CuSO4
C. Na→NaOH→Na2CO3 D. Fe(OH)3→Fe2O3→Fe3+
难度: 中等查看答案及解析
-
当光束通过蛋白质水溶液时,从侧面观察到一条光亮的“通路”,说明蛋白质水溶液是( )
A. 胶体 B. 溶液 C. 悬浊液 D. 乳浊液
难度: 简单查看答案及解析
-
下列过程属于物理变化的是( )
A. 伐薪烧炭 B. 酿酒成醋 C. 焰色反应 D. 百炼成钢
难度: 简单查看答案及解析
-
下列各组物质相互作用,生成物不随反应条件或反应物的用量变化而变化的是( )
A. AlCl3和NaOH B. Fe和Cl2 C. Na和O2 D. Na2CO3和HCl
难度: 简单查看答案及解析
-
下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3

C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
难度: 简单查看答案及解析
-
下列物质属于电解质的是( )
A. 熔融 NaCl B. 稀硫酸 C. SO2 D. 铜
难度: 简单查看答案及解析
-
下列实验现象的描述中正确的是( )
A. 向碘水中加入四氯化碳振荡,静置,观察到下层溶液呈紫红色
B. 将二氧化碳通入氯化钙溶液中,产生白色沉淀
C. 用激光笔照射置于暗处的硫酸铜溶液,发现溶液中有一条光亮的“通路”
D. 向氨水中滴加三氯化铁溶液中,先有红褐色沉淀生成后红褐色沉淀消失
难度: 简单查看答案及解析
-
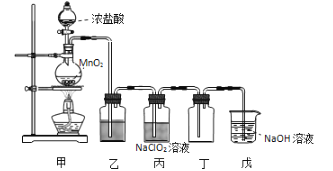
下列反应的离子方程式正确的是
A. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3↓+3H+
B. 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C. 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-
Cl2↑+Mn2++H2O
D. 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
难度: 中等查看答案及解析
-
下列有关“100mL 0.25mol·L—1 BaCl2溶液”的说法正确的是( )
A. 其中Cl—的物质的量浓度为0.50mol
B. 其中Ba2+物质的量浓度为0.25mol·L—1
C. 从中取出10mLBaCl2溶液,溶质的物质的量浓度为0.025mol·L—1
D. 将该溶液稀释到200mL,溶质的物质的量为0.050mol
难度: 中等查看答案及解析
-
下列关于氯水的说法中,不正确的是( )
A. 氯水是纯净物 B. 新制氯水显酸性
C. 新制氯水具有漂白作用 D. 新制氯水应避光保存
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 常温常压下,2.24L Cl2溶于水,转移的电子数目为0.1NA
B. 常温常压下,71g氯气与足量铁粉充分反应,转移的电子数为2NA
C. 标准状况下,11.2L 酒精中含有分子的数目为0.5NA
D. 通常状况下,2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA
难度: 简单查看答案及解析
-
下列有关图示实验正确的是
A.
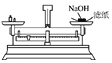 称量NaOH固体 B.
称量NaOH固体 B. 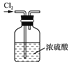 干燥Cl2 C.
干燥Cl2 C. 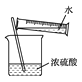 稀释浓硫酸 D.
稀释浓硫酸 D. 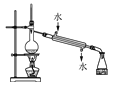 石油的分馏
石油的分馏难度: 中等查看答案及解析
-
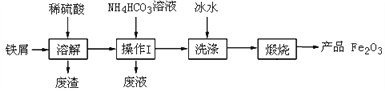
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是( )
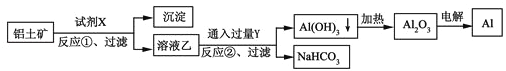
A. 试剂X氢氧化钠溶液
B. 反应①、过滤后所得沉淀为红褐色Fe2O3
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
实验操作
现象
结论
A
将气体通入灼热的 CuO 固体
固体由黑色变为红色
该气体一定为 CO
B
向某溶液中加入 1~2 滴 KSCN 溶液
生成血红色沉淀
该溶液中含 Fe3+
C
向 Al(OH)3 中加入 HCl 或 NaOH 溶液
固体均溶解
Al(OH)3 是两性氢氧化物
D
将 SO2 通入到酸性 KMnO4 溶液中
溶液紫红色褪去
SO2 具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将 Na2SO4、MgSO4、H2SO4 溶于水配成 0.2 L 混合溶液,部分离子浓度如图 所示,下列说法错误的( )
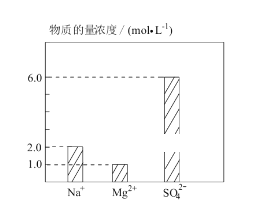
A. 该混合溶液中 Na2SO4 的物质的量为 0.2 mol
B. 该混合溶液中 H+的物质的量浓度为 8mol·L-1
C. 若将该混合溶液加水稀释至体积为 1 L,稀释后溶液中SO42-的物质的量浓度为 1.2 mol·L-1
D. 若向该混合溶液中逐滴加入 2 mol·L-1NaOH 溶液至Mg2+恰好完全沉淀,需 NaOH 溶液 200 mL
难度: 中等查看答案及解析