-
下列说法不正确的是
A. 风力、化石燃料、天然铀矿都是一次能源
B. 开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径
C. 用脫硫处理的煤代替原煤作燃料可以有效减少空气中CO2气体的含量
D. 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
难度: 简单查看答案及解析
-
对于a、b、c、d四块金属片,若a、b用导线相连浸泡在稀H2SO4中,电子由a流向b;c、d用导线相连浸泡在稀H2SO4时,d产生大量气泡;a、c用导线相连浸泡在稀CuSO4中时,c上附着上一层红色物质;d浸泡在b的硝酸盐溶液中,置换出b的单质。由这四种金属的活动顺序由大到小为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
难度: 中等查看答案及解析
-
C、CO、CH4、C2H5OH是常用的燃料,它们每1mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0kJ、890.3kJ、1 366.8kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是( )
A. C B. CO C. CH4 D. C2H5OH
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法正确的是
A. 二氧化硫有毒,一定不能用作食品添加剂
B. 二氧化硅有半导体性能,可用于制作光电池
C. 爆竹燃放过程中,硫燃烧直接生成三氧化硫
D. 同位素示踪技术常用于医疗、考古及物质变化规律的探究
难度: 中等查看答案及解析
-
下列关于元素周期表的叙述不正确的是
A. 元素种类最多的族是第ⅢB族 B. 第ⅠA族元素单质均能与水反应
C. 第ⅡA族中无非金属元素 D. 元素周期表中金属元素的种类比非金属元素多
难度: 中等查看答案及解析
-
下列各图为元素周期表的一部分,表中的数字为原子序数,其中M的原子序数为37的是
A.
B.
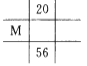 C.
C. 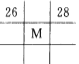 D.
D. 难度: 中等查看答案及解析
-
2 mol某金属单质与足量的盐酸反应,放出67.2L H2(标准状况),并转变为具有Ne原子电子层结构的离子,该金属元素在元素周期表中的位置是
A. 第三周期第ⅠA族 B. 第三周期第ⅡA族
C. 第三周期第ⅢA族 D. 第四周期第ⅢA族
难度: 困难查看答案及解析
-
根据元素周期表和元素周期律分析下面的推断,其中错误的是
A. 碘的氢化物不稳定 B. 铍(Be)的原子失电子能力比镁弱
C. 硒(Se)化氢比硫化氢稳定 D. 氢氧化钠比氢氧化镁的碱性强
难度: 困难查看答案及解析
-
俄罗斯科学家用铪和钨两种核素精确测定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据18272Hf(铪-182)和18274W(钨-182)两种核素的含量比例得出的。下列有关铪-182和钨-182的关系说法正确的是
A. 在周期表中处于相邻位置 B. 互为同位素
C. 电子数相同 D. 中子数分别为110个 和108个
难度: 中等查看答案及解析
-
化学科学需要借助化学专用术语来描述,下列有关化学用语的使用正确的是
A. CaF2的电子式:
B. Cl–的结构示意图:
C. CO2的结构式:O=C=O D. 中子数为20的氯原子:1737Cl
难度: 中等查看答案及解析
-
下列物质中含有共价键的离子化合物是
①MgCl2 ②Na2O2 ③KOH ④CO2 ⑤NaClO ⑥H2SO4 ⑦NH3·H2O
A. ②③⑤ B. ②③④⑤ C. ①②③⑤ D. ①③⑤⑥
难度: 困难查看答案及解析
-
下列关于化学键的说法不正确的是
A. 化学键是一种作用力
B. 化学键可以使离子相结合,也可以使原子相结合
C. 化学反应过程中,反应物分子内的化学键断裂,产物中的化学键形成
D. 极性键、非极性键和氢键等都属于共价键
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A. 20g 重水(D2O)中所含的中子数为8NA
B. 常温下,1 mol NH4Cl含共价键数目为4NA
C. 足量的Cu与含溶质2mol的浓H2SO4反应,转移的电子数为2NA
D. 常温常压下,12g 14C所含原子数为NA
难度: 简单查看答案及解析
-
四种短周期元素在周期表中的相对位置如下所示,其中这四种元素原子的最外层电子数之和为20。下列说法中正确的是
X
Y
Z
W
A. 最高价氧化物的水化物的酸性强弱:Z>Y>X
B. WO2是一种有毒气体,但不属于酸性氧化物
C. 常见气态氢化物稳定性:W>Z>Y>X
D. XW2中各原子最外层均达到8电子稳定结构
难度: 困难查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将铁粉加入稀硝酸中
铁粉溶解,有气体生成
产生的气体为 H2
B
将铜粉加入 Fe2(SO4)3 溶液中
铜粉溶解
金属性:Cu>Fe
C
用坩埚钳夹住一小块用砂纸仔细 打磨过的铝箔在酒精灯上加热
熔化后的液态铝未滴落 下来
熔点:Al>Al2O3
D
将 KI 和 FeCl3 溶液在试管中混合 后,加入 CCl4,振荡,静置
下层溶液显紫红色
氧化性:Fe3+>I2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。Z的单质为黄绿色气体,此气体同冷烧碱溶液作用,可得到含YZW的溶液,具有漂白性。下列说法正确的是
A. 原子半径大小为W<X<Y<Z
B. X的氢化物水溶液酸性强于Z的
C. Y的氢化物为离子化合物
D. X与Z具有相同的最高化合价
难度: 困难查看答案及解析
-
金刚石和石墨是碳元素的两种结构不同的单质(同素异形体),在100kPa时,lmol石墨转化为金刚石,要吸收1.895kJ的热能。下列说法不正确的是
A. 石墨比金刚石稳定
B. 金刚石和石墨的物理性质相同
C. 1mol金刚石比1mol石墨的总能量高
D. lmol金刚石完全燃烧释放的能暈比1mol石墨完全燃烧释放的能量多
难度: 简单查看答案及解析
-
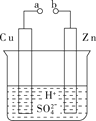
汽车的启动电源常用蓄电池。其结构如下图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
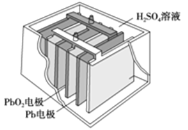
A. Pb作为负极,失去电子,被氧化
B. PbO2得电子,被还原
C. 负极反应是Pb+SO42--2e-===PbSO4
D. 电池放电时,溶液酸性增强
难度: 困难查看答案及解析
-
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O===4Al(OH)3,下列说法不正确的是( )
A. 正极反应式为O2+2H2O+4e-===4OH-
B. 电池工作时,电流由铝电极沿导线流向铂电极
C. 以网状的铂为正极,可增大与氧气的接触面积
D. 该电池通常只需更换铝板就可继续使用
难度: 中等查看答案及解析
-
在2 L容积不变的容器中,发生N2+3H2
2NH3的反应。现通入H2和N2发生反应,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s内消耗N2的物质的量是( )
A. 2.4 mol B. 1.2 mol C. 0.8 mol D. 0.4 mol
难度: 简单查看答案及解析
-
对于100 mL 1 mol/L盐酸与铁片的反应,采取下列措施:①升高温度;②改用100 mL 3 mol/L盐酸;③多用300 mL 1 mol/L盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸。其中能使反应速率加快的是
A. ①②④ B. ①③④ C. ①②③④ D. ①②③⑤
难度: 中等查看答案及解析
-
将a g块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如下图中的实线所示,在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应,则相应的曲线(图中虚线所示)正确的是
A.
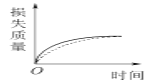 B.
B. 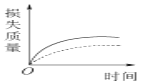 C.
C. 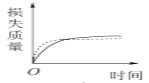 D.
D. 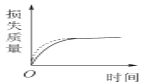
难度: 中等查看答案及解析
-
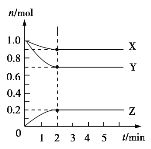
如图是可逆反应X2+3Y2
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是
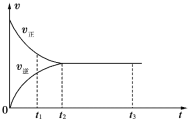
A. t1时,只有正方向反应
B. t2~t3,反应仍在进行
C. t2时,反应到达限度
D. t2~t3,各物质的浓度不再发生变化
难度: 困难查看答案及解析
-
在密闭容器中进行反应2SO2+O2
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①② B. ①③ C. ① D. ③
难度: 中等查看答案及解析