-
《中国诗词大会》不仅弘扬了中国传统文化,还蕴含着许多化学知识,下列诗词分析不正确的是:
A. 绘制《山水画》所用的纸和墨的主要成分都是有机物
B. 刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始到金”,金性质稳定,可通过物理方法得到
C. 王安石诗句“爆竹声中一岁除,春风送暖入屠苏”,爆竹的燃放涉及氧化还原反应
D. 曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能。
难度: 简单查看答案及解析
-
关于 100ml0.1 mol/L H2SO4 溶液的叙述错误的是:
A. 该溶液中含有O 原子的物质的量为 0.04mol
B. 该溶液中氢离子的物质的量浓度为 0.2 mol/L
C. 该溶液的酸性与 0.2 mol/LNaHSO4 溶液相同
D. 取该溶液 10 mL,加水稀释至 100 mL 后 H2SO4 的物质的量浓度为 0.01 mol/L
难度: 中等查看答案及解析
-
下列说法不正确的是:
A. 配制一定物质的量浓度的溶液时,容量瓶是否干燥对配制结果无影响
B. 在进行钠与水反应的实验时,多余的钠需要放回原试剂瓶中
C. 丁达尔效应是由于胶体粒子对光的散射形成的
D. 已知钠与水反应比钠与乙醇反应更剧烈,所以两种电解质的活泼性:钠大于乙醇
难度: 中等查看答案及解析
-
下列离子方程式正确的是:
A. 向稀 HNO3 中滴加Na2SO3 溶液:SO32-+2H+===SO2↑+H2O
B. 向 Na2SiO3 溶液中通入过量 SO2:SiO32-+SO2+H2O===H2SiO3↓+SO32-
C. 向 CuSO4 溶液中加入 Na2O2:2Na2O2+2Cu2++2H2O===4Na++2Cu(OH)2↓+O2↑
D. 向 Al2(SO4)3 溶液中加入过量 NH3·H 2O:Al3++4NH3·H 2O===AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
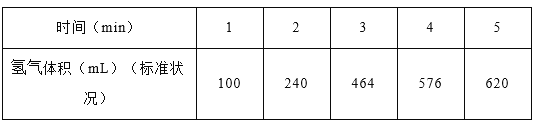
在 200mL 含等物质的量 HBr 和H2SO3 的溶液中通入 0.01molCl2,有一半 Br-变为 Br2(已知 Br2 能氧化 H2SO3),原溶液中 HBr 和 H2SO3 的浓度都等于 :
A. 0.0075mol•L-1 B. 0.0018mol• L-1 C. 0.04mol• L-1 D. 0.08mol•L L-1
难度: 中等查看答案及解析
-
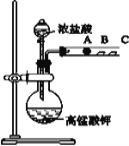
如图是化学课外活动小组设计的用化学电源使 LED 灯发光的装置示意图。下列有关该装置的说法正确的是:

A. 铜片为负极,其附近的溶液变蓝,溶液中有 Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED 灯将不会发光
难度: 中等查看答案及解析
-
从金属利用的历史看,先是青铜器时代,而后是铁器时代,铝的冶炼是近百年的事.决定金属使用年代先后顺序的关键因素是:
A. 金属的活动性 B. 金属的导电性 C. 金属的延展性 D. 地壳中金属元素的含量
难度: 简单查看答案及解析
-
下列离子的检验方法合理的是:
A. 向某溶液中滴入稀 NaOH 溶液未生成使红色石蕊试纸变蓝的气体,说明不含NH4+
B. 向某溶液中通入 Cl2,然后再加入 KSCN 溶液变红色,说明原溶液中含有 Fe2+
C. 向某溶液中加入盐酸酸化的氯化钡溶液,得到白色沉淀,说明溶液中含有 SO42-
D. 向某溶液中加入硝酸酸化的硝酸银溶液得白色沉淀,说明溶液中含有 Cl-
难度: 中等查看答案及解析
-
下列物质能使品红溶液褪色,且褪色原理基本相同的是:
①活性炭②新制氯水③二氧化硫④臭氧⑤过氧化钠⑥双氧水
A. ①②④ B. ②③⑤ C. ②④⑤⑥ D. ③④⑥
难度: 中等查看答案及解析
-
已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓) ===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是:
①CO2②HCl③H2O④O2
A. ①②③ B. ②③④ C. ②③ D. ①④
难度: 简单查看答案及解析
-
下列叙述中正确的是:
A. 周期表中第 15 列元素的最高价氧化物对应水化物的化学式均为 H3RO4
B. O2-与S2-的具有不同的质子数和电子数
C. 元素周期表中前 6 周期一共有 22 种非金属
D. 氕化锂、氘化锂、氚化锂作为“长征 2 号”火箭发射的重要燃料,LiH、LiD、LiT 的化学性质不同
难度: 中等查看答案及解析
-
W、X、Y、Z 四种短周期主族元素在周期表中的相对位置如图所示,由此可知:
X
Y
W
Z
A. Z 元素氢化物的水溶液一定是强酸
B. 四种元素原子形成的简单离子,半径最小的一定是 Y
C. 四种元素最高价氧化物对应的水化物酸性最强的一定是 Y
D. 四种元素对应的简单氢化物稳定性最强的一定是Y
难度: 中等查看答案及解析
-
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是:
A. 天然气、石油、流水、风力、氢气为一次能源
B. 无论是风力发电还是火力发电,都是将化学能转化为电能
C. PM2.5 含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D. 发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
难度: 简单查看答案及解析
-
已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1,下列说法正确的是:
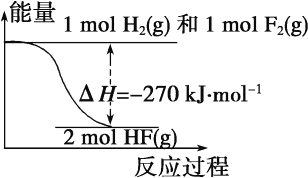
A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2 与 1 mol F2 反应生成 2 mol 液态 HF 放出的热量小于 270 kJ
C. 在相同条件下,1 mol H2与 1 mol F2的能量总和小于 2 mol HF 气体的能量
D. 该反应中的能量变化可用如图来表示
难度: 中等查看答案及解析
-
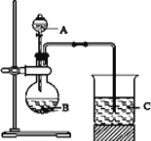
取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是:
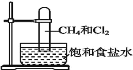
A. 为加快化学反应速率,应在强光照射下完成
B. 甲烷和 Cl2 反应后试管内壁的油状液滴物包括 CH3Cl 、CH2Cl2、CHCl3、CCl4
C. 盛放饱和食盐水的水槽底部会有少量晶体析出
D. CH4 和 Cl2 完全反应后液面上升,液体充满试管
难度: 中等查看答案及解析