-
下列能说明氯元素比硫元素非金属性强的是( )
①HCl比H2S稳定;②HClO4酸性比H2SO4强;③Cl2能与H2S反应生成S;④Cl原子最外层有7个电子,S原子最外层有6个电子;⑤Cl2比S更易与H2化合生成相应气态氢化物;⑥盐酸是强酸,而氢硫酸是弱酸。
A. ①②③④⑤⑥ B. ①②③④⑥ C. ①②③⑤ D. ②④⑥
难度: 困难查看答案及解析
-
下列化合物中的化学键中,既有离子键又有共价键的是
A.H2O B.NaCl C.NH4Cl D.HCl
难度: 中等查看答案及解析
-
下列关于元素周期表应用的说法正确的是( )
A. 在过渡元素中,可以找到半导体材料
B. 在ⅠA、ⅡA族元素中,寻找制造农药的主要元素
C. 在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料
D. 为元素性质的系统研究提供指导,为新元素的发现提供线索
难度: 简单查看答案及解析
-
元素性质呈周期性变化的决定因素是( )
A. 元素原子半径大小呈周期性变化 B. 元素原子量依次递增
C. 元素原子核外电子排布呈周期性变化 D. 元素的最高正化合价呈周期性变化
难度: 简单查看答案及解析
-
根据下列短周期元素性质的数据判断,下列说法正确的是( )
①
②
③
④
⑤
⑥
⑦
⑧
原子半径/10-10m
0.66
1.36
1.23
1.10
0.99
1.54
0.70
1.24
最高价或最低价
-2
+2
+1
+5、-3
+7、-1
+1
+5、
-3
+3
A. 元素④⑤形成的化合物是离子化合物
B. 元素⑦位于第二周期第V族
C. 元素①⑧形成的化合物具有两性
D. 元素③的最高价氧化物对应水化物的碱性最强
难度: 简单查看答案及解析
-
下列有关化学用语表达正确的是( )
A.
和
离子结构示意图均可以表示为:
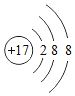
B. 质子数为92、中子数为146的U原子:
C. 碳酸氢钠溶于水的电离方程式:NaHCO3===Na++H++CO32-
D. HF的电子式:
难度: 简单查看答案及解析
-
下列物质之间的转化都一步能实现的是
A. Si→SiO2→H2SiO3→Na2SiO3
B. Al→Al2O3→Al(OH)3→NaAlO2
C. N2→NH3→NO→NO2→HNO3→NO2
D. S→SO3→H2SO4→SO2→Na2SO3→Na2SO4
难度: 中等查看答案及解析
-
某溶液中有
、
、
、
等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目维持不变的阳离子是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
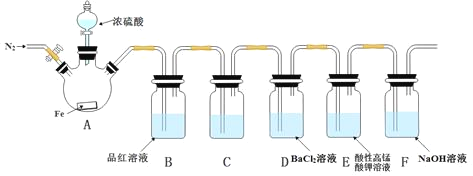
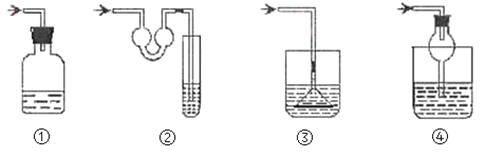
下列实验过程中,始终无明显现象的是
A.
通入
溶液中
B.
通入
溶液中
C.
通入
溶液中
D.
通入酸化的
溶液中
难度: 中等查看答案及解析
-
将
明矾溶于水形成100mL溶液,以下说法正确的是
A. 明矾净水是利用了明矾的强氧化性
B. 溶液的焰色反应为紫色,这是化学性质
C. 加入
溶液至沉淀物质的量达到最大,消耗
溶液
D. 加入
溶液至
恰好完全沉淀,
全部转化为
难度: 中等查看答案及解析
-
核内中子数为N的
离子,质量数为A,则ng它的氧化物中所含质子的物质的量是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已知
、
、
、
四种离子均具有相同的电子层结构
下列关于X、Y、Z、W四种元素的描述,不正确的是
A. 原子序数:
B. 离子半径:
C. 原子最外层电子数:
D. 还原性:
难度: 中等查看答案及解析
-
下列有关元素周期表结构的说法正确的是
A. 原子最外层电子数为2的元素一定处于周期表IIA族
B. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
C. 某元素原子核外的电子数为63,则它是第6周期副族元素
D. 除短周期外,其他周期均为18种元素,副族元素没有非金属元素
难度: 中等查看答案及解析
-
图中的数字代表的是原子序数,图中数字所表示的元素与它们在元素周期表中的实际位置相符的是( )
A.
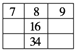 B.
B. C.
D.
难度: 中等查看答案及解析
-
短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )
A. a是一种活泼的非金属元素
B. c的最高价氧化物的水化物是一种弱酸
C. b的氢化物很稳定
D. b元素的最高化合价为+7价
难度: 简单查看答案及解析
-
下列原子序数所对应的元素组中,两者可形成离子键的是
A. 1和17 B. 12和9 C. 14和6 D. 15和8
难度: 简单查看答案及解析
-
下列说法正确的是( )
①金属和非金属化合形成离子键
②离子键是阳离子,阴离子的相互吸引
③两个非金属原子间不可能形成离子键
④非金属原子间不可能形成离子键
⑤离子化合物可能含有共价键
⑥共价化合物中可能有离子键
A.
B.
C. ③ ⑤ D.
难度: 中等查看答案及解析