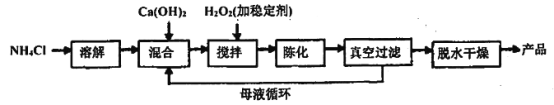
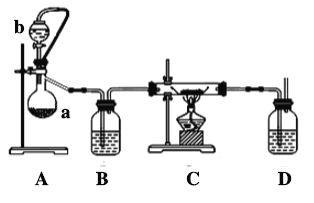
-
下列叙述正确的是
A. 合金材料中可能含有非金属元素
B. 日常生活中无水乙醇常用于杀菌消毒
C. 核电站是把化学能转化成电能
D. 人造纤维、合成纤维和光导纤维都是有机高分子化合物
难度: 简单查看答案及解析
-
下列有关物质性质与用途对应关系合理的是
A. 硫酸铜溶液可以使蛋白质变性,可用来浸泡毛豆以保持新鲜绿色
B. 浓H2SO4有脱水性,可用作干燥剂
C. NaHCO3能与酸反应,可用于治疗胃酸过多
D. SO2具有氧化性,可用于漂白纸浆
难度: 中等查看答案及解析
-
下列实验操作正确的是
编号
实验目的
操作
A
除去C2H4中的SO2
通入盛有氢氧化钠溶液的洗气瓶
B
制备乙酸乙酯
加入试剂的顺序为浓硫酸、无水乙醇、冰醋酸
C
检验溶液中是否含SO42-
加入盐酸酸化的BaCl2溶液,看是否有沉淀生成
D
除去Cu粉中混有的CuO
加入浓硝酸充分反应后,过滤、洗涤、干燥
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
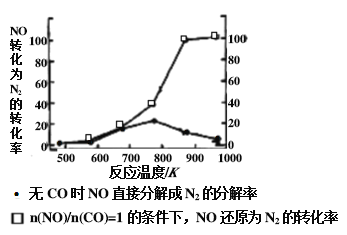
汽车尾气无害化处理反应为2NO(g)+2CO(g)
N2(g)+2CO2(g) ΔH<0。下列说法正确的是
A. 升高温度可使该反应的正反应速率增大,逆反应速率减小
B. 增大压强,可以使NO和CO完全转为为无污染的N2和CO2,而消除污染
C. 该反应反应物总能量小于生成物总能量
D. 使用高效催化剂可降低反应的活化能,增大活化分子百分数,反应速率增大
难度: 中等查看答案及解析
-
电化学降解
的原理如图所示。下列说法不正确的是

A. 铅蓄电池的负极反应为:Pb - 2e-+ SO42- =PbSO4
B. 电解一段时间后,若不考虑溶液体积变化,交换膜左侧溶液酸性增强,右侧溶液酸性减弱
C. 该电解池的阴极反应式为2NO3-+12H++10e-=N2↑+6H2O
D. 若电解过程中转移2mole-,则质子交换膜左侧电解液的质量减少Δm(左) =18.0g
难度: 中等查看答案及解析
-
常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入40 mL浓度为0.1 mol·L-1的盐酸,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是
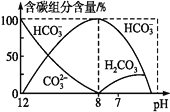
A. 在混合溶液中,H2CO3、HCO3-、CO32-能大量共存
B. 当pH=7时,溶液中离子浓度的大小关系为c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(CO32-)>c(OH-)
C. 已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh
=2.0×10-4,当溶液中(HCO3-):(CO32-)= 2:1时,溶液的pH=10
D. Kh不受温度的影响,升高温度,溶液中各种离子浓度不变
难度: 中等查看答案及解析