-
2015年10月,浙江籍科学家屠呦呦因发现青蒿素(C15H22O5)而获得诺贝尔生理学或医学奖,根据物质的分类,青蒿素属于( )
A. 有机物 B. 碱性氧化物 C. 含氧酸盐 D. 酸性氧化物
难度: 简单查看答案及解析
-
钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A. 用来做保险丝 B. 用于制造航天飞机
C. 用来制造人造骨 D. 用于家庭装修,做钛合金装饰门
难度: 简单查看答案及解析
-
有科学家提出,硅是“21世纪的能源”,下面有关硅的叙述中,正确的是( )
A. 硅单质化学性质不活泼,常温下不与任何物质反应
B. 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C. 硅的化学性质不活泼,在自然界中可以以游离态存在
D. 硅在电子工业中,是重要的半导体材料
难度: 中等查看答案及解析
-
下列有关硅及其化合物的说法不正确的是( )
A. 石灰石是工业制备普通玻璃和普通水泥的共同原料
B. 盛放NaOH溶液不能用带玻璃塞的玻璃瓶
C. SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应
D. 除去SiO2中混有的CaCO3可加入适量的稀盐酸后过滤
难度: 中等查看答案及解析
-
将表面已完全钝化的铝条插入下列溶液中,不会发生反应的是( )
A. 硫酸铜 B. 氢氧化钠 C. 稀硝酸 D. 稀盐酸
难度: 中等查看答案及解析
-
在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,一定能大量共存的是( )
A. NH4+、SO42-、CO32-、K+ B. Na+、Ba2+、Ca2+、HCO3-
C. Mg2+、Ag+、K+、Cl- D. K+、Cl-、Na+、SO42-
难度: 中等查看答案及解析
-
铝热反应的实验装置如图。下列有关铝热反应的说法中,不正确的是( )
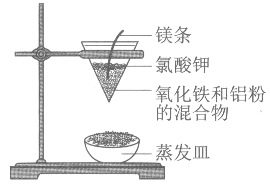
A. 工业上可以利用铝热反应的方法冶炼金属镁
B. 铝热反应可用于冶炼某些高熔点金属
C. 铝热反应体现了铝的还原性
D. 实验现象为火星四溅,漏斗下方有红热熔融物流出
难度: 中等查看答案及解析
-
下列有关氧化铝和氢氧化铝的说法中,不正确的是( )
A. 氧化铝的熔点高,是一种比较好的耐火材料,可用来制造耐火坩埚
B. 氯化铝溶液中加入过量氨水的离子方程式为:Al3++3NH3·H2O =Al(OH)3↓+3NH4+
C. 氢氧化铝能凝聚水中的悬浮物和吸附色素,可用于净水
D. 实验室通常将氢氧化钠溶液滴入氯化铝溶液制取氢氧化铝
难度: 中等查看答案及解析
-
改革开放40年,我国取得了很多世界瞩目的科技成果,下列说法不正确的是( )
A.
 蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素
蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素B.
 港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能C.
 国产C919用到的氮化硅陶瓷是新型无机非金属材料
国产C919用到的氮化硅陶瓷是新型无机非金属材料D.
 中国天眼传输信息用的光纤材料是硅
中国天眼传输信息用的光纤材料是硅难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知,下列说法正确的是( )
W
X
Y
Z
A. W、Z的气态氢化物相遇反应并有白烟生成,该物质为共价化合物
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X、Y两元素的最高正价相等
D. 最简单的气态氢化物的稳定性:Z>Y
难度: 中等查看答案及解析
-
共价键、离子键是构成物质微粒间的不同作用力,下列给出的物质中,含有上述两种作用力的是( )
A. NaOH B. Na2O C. H2SO4 D. MgCl2
难度: 中等查看答案及解析
-
食盐(NaCl)是生活中常用的调味品,胃酸的主要成分是盐酸。下列关于两种物质的说法正确的是( )
A. 炒菜时放入食盐并不破坏NaCl中的化学键
B. 胃舒平(主要成分氢氧化铝)与胃酸反应生成的AlCl3属于离子化合物
C. HCl溶于水时会电离出H+和Cl-,但HCl属于共价化合物
D. HCl的电子式是
难度: 中等查看答案及解析
-
下列叙述中不正确的是( )
A. 化学键的断裂和形成是化学反应能量变化的主要原因
B. 化学键存在所有单质和化合物中
C. 含有共价键的化合物不一定是共价化合物
D. N2分子中含有的共价键很强,故N2分子比较稳定
难度: 中等查看答案及解析
-
下列反应过程中能量变化的趋势与下图一致的是( )
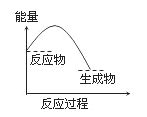
A. C + CO2
2CO
B. CaCO3
CaO + CO2↑
C. 2Al + Fe2O3
2Fe + Al2O3
D. Ba(OH)2·8H2O + 2NH4Cl==BaCl2 + 2NH3↑+ 10H2O
难度: 中等查看答案及解析
-
下列选项中描述的过程能实现热能转化为化学能的是( )
A. 燃料电池
 B. 火力发电
B. 火力发电
C. 天然气燃烧
 D. 煅烧石灰石
D. 煅烧石灰石
难度: 简单查看答案及解析
-
已知1gH2完全燃烧生成水蒸气放出热量121kJ,且O2中1molO=O键完全断裂时吸收热量496kJ,水蒸气中形成1molH—O键时放出热量463kJ,则H2中1molH—H键断裂时吸收的热量为( )
A. 920kJ B. 557kJ C. 436kJ D. 188kJ
难度: 中等查看答案及解析
-
1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2
2NH3,有关说法正确的是
A. 不同的催化剂对化学反应速率影响均相同
B. 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C. 新法合成能在常温下进行是因为不需要断裂化学键
D. 哈伯法合成氨是吸热反应,新法合成氨是放热反应
难度: 中等查看答案及解析
-
用稀硫酸与过量锌粒反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施不可行的是( )
A. 升高温度 B. 滴加少量浓硫酸
C. 滴加少量硫酸铜溶液 D. 改用等质量的锌粉
难度: 简单查看答案及解析
-
在500℃和催化剂存在的条件下,某固定容积的容器中发生反应:2SO2(g)+O2(g)
2SO3(g)(正反应放热)。下列有关说法正确的是( )
A. 达到化学平衡时,混合气体中SO3的质量分数不再变化
B. 在上述条件下,SO2能完全转化为SO3
C. 达到化学平衡时,正反应和逆反应的速率相等且都为零
D. 达到平衡时,SO2和SO3的浓度一定相等
难度: 中等查看答案及解析
-
180℃时将0.5 mol H2和1 mol CO2通入1L的恒容密闭容器中,反应生成甲醇蒸汽(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法中正确的是( )
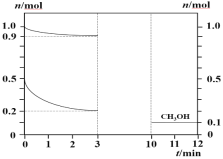
A. 该反应的化学方程式:2CO2+4H2
2CH3OH+O2
B. 在0~3 min内H2的平均化学反应速率为0.1 mol·L-1·min-1
C. 当容器内混合气体密度不再变化时,表明反应已经达到平衡状态
D. 在3~10 min内,反应仍未达到平衡状态
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
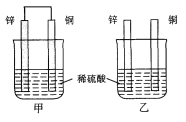
A. 两烧杯中铜片表面均无气泡产生
B. 甲、乙两装置均将化学能转变为电能
C. 两烧杯中溶液均变蓝色
D. 一段时间后,两烧杯中溶液的c(H+)均减小
难度: 中等查看答案及解析
-
有A、B、C、D四块金属片,进行如下实验,据此判断四种金属的活动顺序是( )
①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;
②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;
③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;
④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。
A. A>C>D>B B. A>B>C>D C. C>A>B>D D. B>D>C>A
难度: 简单查看答案及解析
-
下列说法正确的是
A. 含有10个中子的氧原子核素符号:
O
B. CH3CH2CH2CH2CH3和
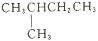 互为同素异形体
互为同素异形体C.
和
互为同分异构体
D. 乙烯的球棍模型:
难度: 中等查看答案及解析
-
实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
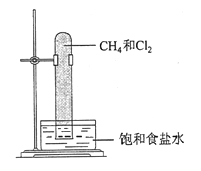
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是
A.
 B.
B. 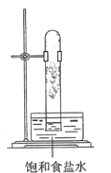 C.
C. 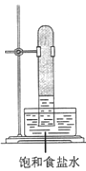 D.
D. 
难度: 简单查看答案及解析
-
既可用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是( )
A. 慢慢通入水中 B. 催化加氢
C. 慢慢地通入溴水中 D. 慢慢地通入酸性高锰酸钾溶液中
难度: 简单查看答案及解析