-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
用热的烧碱溶液洗去油污
Na2CO3可直接和油污反应
B
漂白粉在空气中久置变质
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3
C
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
D
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含有Cu2+的溶液中置换出铜
难度: 中等查看答案及解析
-
北魏贾思勰《齐民要术·作酢法》这样描述苦酒:“乌梅苦酒法:乌梅去核,一升许肉,以五升苦酒渍数日,曝干,捣作屑。欲食,辄投水中,即成醋尔。”下列有关苦酒主要成分的说法正确的是( )
A. 苦酒的主要溶质是非电解质 B. 苦酒的主要溶质是弱电解质
C. 苦酒的主要溶质是强电解质 D. 苦酒的溶液中只存在分子,不存在离子
难度: 简单查看答案及解析
-
下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3kJ·mol−1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=−890.3 kJ·mol−1
B. 500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=−38.6kJ·mol−1
C. 已知在120℃、101kPa下,1g H2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+1/2O2(g)=H2O(g) ΔH=−242kJ·mol−1
D. 25℃、101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol−1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=−57.3kJ·mol−1
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A. 体系有序性越高,熵值就越低 B. 自发过程可以导致体系的熵增大
C. 同种物质气态时熵值最大 D. 吸热反应不可以自发进行
难度: 简单查看答案及解析
-
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
难度: 中等查看答案及解析
-
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍 B. 该溶液的pH=4
C. 此酸的电离平衡常数约为1×10-7 D. 升高温度,溶液的pH增大
难度: 中等查看答案及解析
-
一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O
CH3COOH+OH-,下列说法正确的是( )
A. 稀释溶液,溶液的pH增大 B. 加入少量NaOH固体,c(CH3COO-)减小
C. 温度升高,c(CH3COO-)增大 D. 加入少量FeCl3固体,c(CH3COO-)减小
难度: 中等查看答案及解析
-
下列不能用勒夏特列原理解释的事实是( )
A. 棕红色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
难度: 中等查看答案及解析
-
—定条件下,恒压容器中发生反应:2X(g)+Y(g)
2Z(g), △H=-akJ·mol-1(a>0)。下列说法不正确的是( )
A. 单位时间内生成2n mol X,同时生成nmol Y
B. 混合体系的密度不再变化,说明该反应达到化学平衡状态
C. 反应过程中,X和Z的物质的量之和保持不变
D. 向容器中加入0.2 mol X与0.1 molY充分反应,放出热量为0.lakJ
难度: 中等查看答案及解析
-
己知某温度下,0.1mol/LNaHA的强电解质溶液中,c(H+)<c(OH-),则下列关系或说法一定不正确的是
A. c(Na+)=c(HA-)+2c(A2-)+c(OH-) B. c(H2A)+c(HA-)+c(A2-)=0.1mol/L
C. 无法确定水的离子积常数 D. c(A2-)+c(OH-)=c(H+)+c(H2A)
难度: 中等查看答案及解析
-
已知A(g)+B(g)
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是( )
A. 4s时c(B)为0.78 mol/L
B. 该反应AH>0
C. 830℃达平衡时,A的转化率为20%
D. 1200℃时反应C(g)+D(g)
A(g)+B(g)的平衡常数为2.5
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
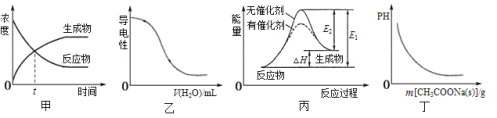
A. 图甲表示某可逆反应物质的浓度随时间的变化,且在t时刻达到平衡状态
B. 图乙表示向0.1 mol·L-1的氨水溶液中逐渐加水时溶液的导电性变化
C. 图丙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
D. 图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化
难度: 困难查看答案及解析