-
下列各组离子中因有配离子生成而不能大量共存的是( )
A. K+、Na+、Cl-、NO3- B. Mg2+、Ca2+、SO42-、OH-
C. Fe2+、Fe3+、H+、NO3- D. Ba2+、Fe3+、Cl-、SCN-
难度: 中等查看答案及解析
-
1999年度诺贝尔化学奖授予了开创“飞秒(10-15s)化学”新领域的科学家,使运用激光光谱技术观测化学反应时分子中原子运动成为可能。你认为该技术不能观察到的是( )
A. 原子中原子核的内部结构 B. 化学反应中原子的运动
C. 化学反应中生成物分子的形成 D. 化学反应中反应物分子的分解
难度: 简单查看答案及解析
-
研究有机物的一般步骤:分离提纯→确定最简式→确定分子式→确定结构式。以下研究有机物的方法错误的是( )
A. 蒸馏——分离提纯液态有机混合物
B. 燃烧法——研究确定有机物成分的有效方法
C. 核磁共振氢谱——分析有机物的相对分子质量
D. 红外光谱图——确定有机物分子中的官能团或化学键
难度: 简单查看答案及解析
-
科学家成功地制成了一种新型的碳氧化合物,该化合物晶体中每个碳原子均以四个共价单键与氧原子结合为空间网状的无限伸展结构。下列对该晶体叙述错误的是( )
A. 晶体的熔、沸点高,硬度大
B. 该物质的化学式为CO4
C. 晶体中C原子数与C—O化学键数之比为1∶4
D. 晶体的空间最小环由12个原子构成
难度: 中等查看答案及解析
-
乙醇分子中各化学键如图所示,下列关于乙醇在不同的反应中断裂化学键的说法错误的是( )
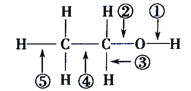
A. 与金属钠反应时,键①断裂
B. 在加热和Cu催化下与O2反应时,键①③断裂
C. 与浓硫酸共热发生消去反应时,键②③断裂
D. 与乙酸、浓硫酸共热发生酯化反应时,键①断裂
难度: 简单查看答案及解析
-
原子序数依次增大的五种短周期主族元素X、Y、Z、P、Q分别位于三个周期,X与Z、Y与P分别位于同主族,Z与Y可形成原子个数比分别为1∶1和2∶1的离子化合物。则下列说法正确的是
A. 简单氢化物的沸点:Q>Y
B. 简单氢化物的热稳定性:Y>Q>P
C. 非金属性强弱:Q>P>Y>X
D. X、Y、Z、P形成的化合物的水溶液显碱性
难度: 中等查看答案及解析
-
俄罗斯用“质子—M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) △H1=-0.92kJ·mol-1
(2)O2(g)=O2(l) △H2=-6.84kJ·mol-1
(3)如图:
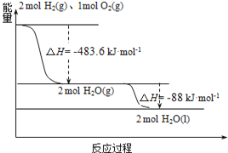
下列说法正确的是( )
A. 2mol H2(g)与1molO2(g)所具有的总能量比2molH2O(g)所具有的总能量低
B. 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l)=2H2O(g) △H=-474.92kJ·mol-1
C. 氢气的燃烧热为△H=-241.8kJ·mol-1
D. H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
难度: 中等查看答案及解析
-
如图是一种可充电的锂离子电池充放电的工作示意图。放电时该电池的电极反应式为:负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)正极:Li1-xMnO2+xLi++xe-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)下列有关说法不正确的是( )
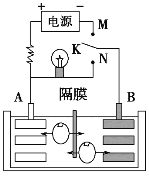
A. 该电池的放电的反应式为Li1-xMnO2+LixC6=LiMnO2+C6
B. K与M相接时,A是阳极,发生氧化反应
C. K与N相接时,Li+由A极区迁移到B极区
D. 在整个充、放电过程中至少存在3种形式的能量转化
难度: 中等查看答案及解析
 B.
B. C.
C. D.
D.
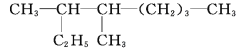 的名称是_______。
的名称是_______。