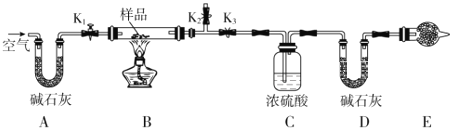
-
大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的一项是
选项
俗名
主要成分(化学式)
用途
A
石英
SiO2
集成电路
B
纯碱
Na2CO3
制备玻璃
C
水玻璃
Na2SiO3
制备硅胶
D
铁红
Fe2O3
用作油漆和涂料
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A. 2.7 g B. 3.6 g C. 5.4 g D. 1.8 g
难度: 中等查看答案及解析
-
对合金的认识错误的是
A. 合金是纯净物 B. 可以由非金属和金属组成的
C. 生铁与钢都是铁碳合金 D. 可以由金属和金属组成的
难度: 中等查看答案及解析
-
下列各组中的两种物质作用,反应条件或反应物的用量改变时,对生成物没有影响的是
A. NaOH与 CO2 B. Na2O2 与CO2 C. NaOH与AlCl3 D. Na与O2
难度: 中等查看答案及解析
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A. 若无固体剩余,则溶液中一定有Fe3+
B. 若有固体存在,则溶液中一定有Fe2+
C. 若溶液中有Cu2+,则一定没有固体析出
D. 若溶液中有Fe2+,则一定有Cu析出
难度: 中等查看答案及解析
-
下列离子方程式错误的是
A. FeSO4酸性溶液暴露在空气中:4Fe2+ +O2 +4H+ = 4Fe3+ +2H2O
B. 为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3-+H+ = H2O+CO2↑
C. 明矾净水的原理:Al3++3H2O = Al(OH)3(胶体)+3H+
D. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2+ + Al3+ + 2SO42-+ 4OH- = AlO2-+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
氢化钠可以作为生氢剂,反应方程式如下:NaH+H2O=NaOH+H2↑,则下列说法正确的是
A. 该反应是氧化还原反应,反应中有2个电子发生转移
B. 该反应是非氧化还原反应
C. 该反应是氧化还原反应,当生成1molH2时,转移电子1mol
D. 该反应的离子方程式为H-+H2O=OH-+H2↑
难度: 简单查看答案及解析
-
下列关于胶体的说法错误的是
A. 可用渗析的方法除去淀粉溶液中的NaCl
B. “卤水点豆腐”、“不同牌子的墨水不能混用”都与胶体的聚沉有关
C. 雾霾属于胶体,它区别于溶液等其它分散系的本质原因是能发生丁达尔现象
D. 电泳现象说明胶体粒子带电
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A. 将l00mL 0.1mol•L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数为0.01NA
B. 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为2NA
C. 7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为0.1NA
D. 过氧化钠与水反应时,生成0.1mol O2转移的电子数为0.1NA
难度: 中等查看答案及解析
-
X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是
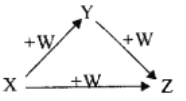
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ②④ B. ①③⑤ C. ①②④⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列说法错误的是
A. SiO2能与HF反应,因此可用HF刻蚀玻璃
B. 向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸胶体
C. 氮化硅是一种重要的结构陶瓷材料,化学式为Si3N4
D. SiO2溶于水显酸性
难度: 简单查看答案及解析
-
用下列装置不能达到有关实验目的的是
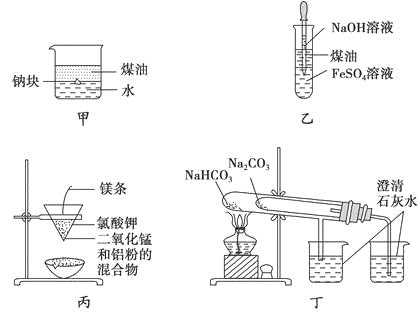
A. 用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B. 用乙图装置制备Fe(OH)2
C. 用丙图装置制取金属锰
D. 用丁图装置比较NaHCO3和Na2CO3的热稳定性
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释错误的是
选项
现象或事实
解释
A
金属钠着火,不能用水扑灭,
应用沙土灭火
金属钠很活泼,能与水剧烈反应并生成氢气
B
K2FeO4用于自来水的消毒和净化
K2FeO4具有强氧化性,被还原后生成的
Fe3+水解生成胶状物,可以吸附水中悬浮物
C
Na2O2用于呼吸面具中作为O2的来源
Na2O2与CO2和H2O反应放出O2
D
节日燃放的烟花颜色五颜六色
是碱金属、锶、钡、铂、铁等金属元素焰色反应呈现的
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列各项操作中符合“先出现沉淀后沉淀完全溶解”现象的有( )组
①向饱和碳酸钠溶液中通入CO2 至过量 ②向Fe(OH)3胶体中逐滴滴加稀H2SO4至过量
③向BaCl2溶液中通入CO2 至过量 ④向澄清石灰水中逐渐通入CO2至过量
⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量
⑥向NaAlO2溶液中逐滴滴加盐酸至过量 ⑦向NaAlO2溶液中逐渐通入CO2至过量
A. 2 B. 3 C. 4 D. 5
难度: 困难查看答案及解析
-
下列图像均为实验过程中产生沉淀的物质的量与加入试剂的量之间的关系图,其中错误的是
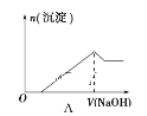
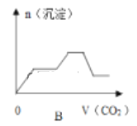
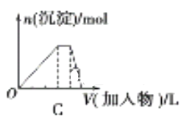
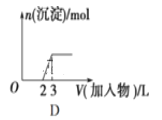
A. 图A表示向MgCl2、AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液至过量
B. 图B表示将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系
C. 图C表示向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D. 图D表示向烧碱溶液中滴加明矾溶液
难度: 中等查看答案及解析
-
向一定量的Fe、Fe3O4、Fe2O3、FeO的混合物中加入200 mL 1 mol·L-1的盐酸,恰好使混合物完全反应溶解,放出4.48 mL(标准状况)气体。所得溶液中,加入KSCN溶液无红色出现,那么用足量的CO在高温下还原相同质量的此混合物,得到铁的质量为
A. 11.2 g B. 5.6 g C. 2.8 g D. 无法计算
难度: 中等查看答案及解析
-
某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—、NO3—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
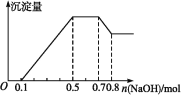
A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—和NO3—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
难度: 中等查看答案及解析