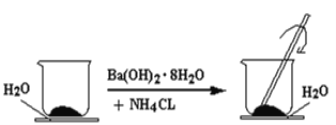
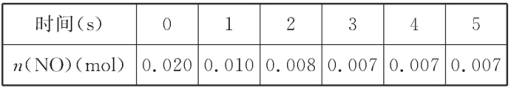
-
下列说法正确的是( )
A.有机物种类繁多的主要原因是有机物分子结构十分复杂
B.烃类分子中的碳原子与氢原子是通过非极性键结合的
C.同分异构现象的广泛存在是造成有机物种类繁多的唯一原因
D.烷烃的结构特点是碳原子通过单键连接成链状,剩余价键均与氢原子结合
难度: 简单查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 中等查看答案及解析
-
下列每组中各物质内既有离子键又有共价键的一组是
A. NaOH、H2SO4、(NH4)2SO4 B. MgO、Na2SO4、NH4HCO3
C. Na2O2、KOH、Na2SO4 D. HCl、Al2O3、MgCl2
难度: 中等查看答案及解析
-
下列说法中肯定错误的是
A. 某原子K层上只有一个电子
B. 某原子M层上电子数为L层电子数的4倍
C. 某离子M层上和L层上的电子数均为K层的4倍
D. 阳离子的最外层电子数可能为2,也可能为8
难度: 中等查看答案及解析
-
下列说法中不正确的是
①质子数相同的微粒一定是同种元素 ②同位素的化学性质基本相同 ③质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子 ④电子数相同的微粒不一定是同一种原子 ⑤某种元素的相对原子质量取整数,就是其质量数
A. ①⑤ B. ③④⑤ C. ①②⑤ D. ②③④
难度: 中等查看答案及解析
-
在长式元素周期表中,元素A、B位于同周期,A在ⅡA族,B在ⅢA族。A的原子序数为x,B的原子序数为y,不可能是
A. y=x+1 B. y=x+10 C. y=x+11 D. y=x+25
难度: 简单查看答案及解析
-
如图中,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
A. 元素b位于第ⅥA族,有+6、-2两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c > d
D. 元素c和e的气态氢化物的稳定性:c > e
难度: 困难查看答案及解析
-
下列各分子中所有原子都满足最外层为8电子结构的是
A. HClO B. PCl5 C. BF3 D. CO2
难度: 简单查看答案及解析
-
100mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A. 加入适量的6 mol·L-1的盐酸 B. 加入数滴氯化铜溶液
C. 加入适量蒸馏水 D. 加入适量的氯化钠溶液
难度: 中等查看答案及解析
-
下列各图中,表示正反应是吸热反应的图是
A.
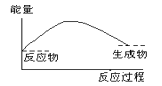 B.
B. 
C.
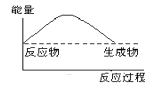 D.
D. 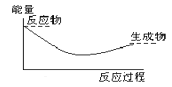
难度: 简单查看答案及解析
-
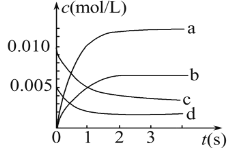
在一定温度下,容器内某一反应中M、N的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
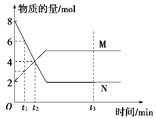
A. 反应的化学方程式为2M
N B. t2时,正、逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率 D. t1时,N的浓度是M浓度的2倍
难度: 中等查看答案及解析
-
已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为
A. 0.5mol·L-1·min-1 B. 1mol·L-1·min-1
C. 2mol·L-1·min-1 D. 3mol·L-1·min-1
难度: 简单查看答案及解析
-
原电池的电极反应不仅与电极材料的性质有关,还与电解质溶液有关。下列说法中不正确的是
A. 由Al、Cu、稀H2SO4组成原电池,其负极反应式为Al-3e-=Al3+
B. 由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-=AlO2-+2H2O
C. 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-=Cu2+
D. 由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-=Cu2+
难度: 中等查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极,②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 简单查看答案及解析
-
等质量的两份锌粉a、b中分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,下列各图表示的是产生H2的体积V与时间t的关系,其中正确的是
A.
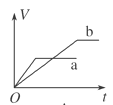 B.
B. 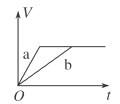
C.
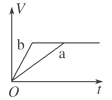 D.
D. 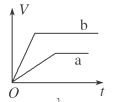
难度: 简单查看答案及解析
-
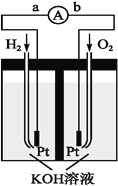
燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池的能量利用率可高达80%,产物污染也少。下列有关燃料电池说法错误的是
A. 氢氧燃料电池的电解质用KOH溶液时,其负极电极反应为2H2-4e-+4OH-===4H2O
B. 碱性甲烷燃料电池的正极反应为O2+2H2O+4e-===4OH-
C. 燃料电池负极燃料失电子,发生还原反应
D. 除纯氧外,空气中的氧气也可以作氧化剂
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A. 催化剂V2O5不改变该反应的逆反应速率 B. 增大反应体系的压强,反应速率一定增大 C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间 D. 在t1、l2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,能说明反应X2(g)+Y2(g)
2XY(g)已达到平衡的是
A. 容器内的总压不随时间变化 B. 容器中气体的平均相对分子质量不随时间变化
C. XY气体的物质的量分数不变 D. X2和Y2的消耗速率相等
难度: 简单查看答案及解析
-
已知H++OH-===H2O生成1 mol H2O放出热量57.3 kJ,下列反应中能放出57.3 kJ热量的是
A. 1mol稀H2SO4与足量NaOH溶液反应 B. 稀盐酸与氨水反应生成1molH2O
C. 稀盐酸与稀Ba(OH)2溶液反应生成1 mol水 D. 稀NaOH与95%浓硫酸反应生成1mol水
难度: 中等查看答案及解析
-
下列反应属于取代反应的是
A. CH4与Cl2的混合气体光照后颜色变浅
B. C2H4通入KMnO4酸性溶液中,溶液褪色
C. 苯与溴水混合后振荡,水层褪色
D. C2H4通入溴水中,溴水褪色
难度: 中等查看答案及解析
-
若如图所示的烷烃结构是烯烃与H2加成后的产物,则烯烃可能的结构有
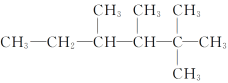
A. 3种 B. 4种 C. 5种 D. 6种
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 分子式相同,各元素质量分数也相同的物质是同种物质
B. 通式相同的不同物质一定属于同系物
C. 分子式相同的不同物质一定是同分异构体
D. 相对分子质量相同的不同物质一定是同分异构体
难度: 简单查看答案及解析
-
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16molCO2和3.6g水,下列说法正确的是
A. 混合气体中不一定有甲烷 B. 混合气体中一定是甲烷和乙烯
C. 混合气体中一定没有乙烷 D. 混合气体中一定有乙炔(CH≡CH)
难度: 中等查看答案及解析
-
下图所示的实验,能达到实验目的的是
A
B
C
D
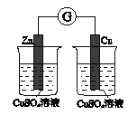
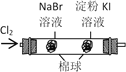
将等体积的
甲烷和氯气
混合光照
5%的H2O2溶
液中滴入2滴
1mol·L-1氯化
铁溶液
验证化学能
转化为电能
验证氧化性Cl2>Br2>I2
得到纯净
的一氯甲烷
验证催化剂加快
反应速率
A. A B. B C. C D. D
难度: 简单查看答案及解析